
(14分)硒34Se和碲52Te都是第VIA族元素,硒是分布在地壳中的稀有元素。工业上用硒鼓废料(主要成分硒、碲、碳、铜和铁合金)回收精炼硒的流程如下: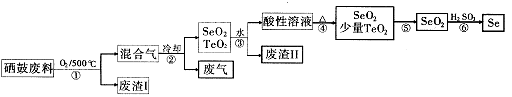
已知: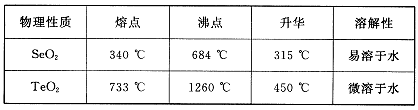
(1)Se的氢化物的电子式是____。
(2)步骤①中通人的氧气使硒鼓废料翻腾,目的是 。
(3)废气的主要成分是____ ;废渣II的主要成分是 。
(4)步骤④中主要反应的化学方程式是 ;步骤⑥反应的化学方程式是 。
(5)根据表中数据,步骤⑤最适宜的分离方法是 。
(14分)
(1)
(2)增大接触面积,加快反应速率,使废料充分燃烧
(3)CO2 TeO2
(4)H2SeO3 SeO2+ H2O 2H2SO3+SeO2=Se+2H2SO4
SeO2+ H2O 2H2SO3+SeO2=Se+2H2SO4
(5)升华,将温度控制在315°C到450°C之间
解析试题分析:(1)Se是第六主族元素,氢化物的化学式与H2O相似,属于共价化合物,电子式为 ;
;
(2)步骤①中通人的氧气使硒鼓废料翻腾,目的是增大接触面积,加快反应速率,使废料充分燃烧
(3)根据硒鼓废料的成分判断,废气是CO2;SeO2易溶于水,TeO2微溶于水,所以废渣主要是TeO2;
(4)SeO2溶于水生成H2SeO3,受热分解生成SeO2,化学方程式为H2SeO3 SeO2+H2O;步骤⑥发生氧化还原反应 ,根据所给反应物和产物写出其化学方程式:2H2SeO3+SeO2=Se+2H2SO4
SeO2+H2O;步骤⑥发生氧化还原反应 ,根据所给反应物和产物写出其化学方程式:2H2SeO3+SeO2=Se+2H2SO4
(5)根据SeO2和TeO2升华的温度,二者分离的最适宜方法是升华。
考点:考查Se元素的性质,电子式、化学方程式的书写,物质分离方法的判断


科目:高中化学 来源: 题型:填空题
某工厂排出的污水中含有大量的Fe2+、Zn2+、Hg2+三种金属离子。以下是某化学研究性学习小组的同学设计的除去污水中的金属离子,回收绿矾、皓矾(ZnSO4·7H2O)和汞的方案。
[药品] NaOH溶液、硫化钠溶液、硫化亚铁、稀硫酸、铁粉
[实验方案]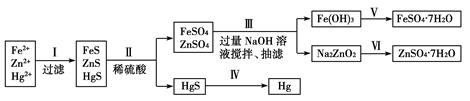
[问题探究]
(1)步骤Ⅱ所发生反应的离子方程式为_________________________________________________。
(2)步骤Ⅲ中的抽滤为减压条件下的过滤,可以加快过滤速度;该步骤涉及反应的离子方程式有Zn2++4OH-=ZnO22-+2H2O和________________。
(3)步骤Ⅵ中得到硫酸锌溶液的离子反应方程式为______________________________。
(4)欲实现步骤Ⅴ,所需加入的试剂有________、________,所涉及的主要操作依次为______________________。
(5)步骤Ⅳ常用的方法是加热,该步骤是否对环境有影响?__________(填“是”或“否”),如有影响,请你设计一个环境保护方案来实现步骤Ⅳ的反应________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
研究小组欲进行从海水中获取淡水、食盐并提取镁和溴等物质的实验探究。
(1)无需经过化学变化就能从海水中获得的一组物质是 (填序号)。
① Cl2、Br2、I2 ② Na、Mg、Al ③烧碱、氢气 ④食盐、淡水
(2)在生产过程中,从海水中提取镁的流程如下图所示: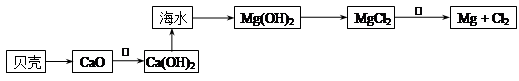
贝壳中的主要成分是:___________(填化学式);反应①属于________反应(填“吸热”或“放热”)。
反应②的化学方程式为 。
(3)实验室从海水样品中提取溴的主要步骤是:向海水样品中通入适量氯气将溴离子氧化,该反应的离子方程式为 ;从反应后的溶液中提取溴单质的实验操作是____________(填实验操作名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某科研小组以难溶性钾长石(K2O?Al2O3?6SiO2)为原料,提取A12O3、 K2CO3等物质,工艺流程如下: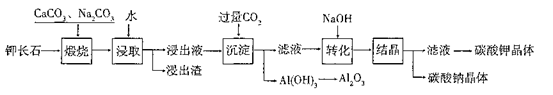
(1)“煅烧”过程中有如下反应发生:
①钾长石中的硅元素在CaCO3作用下转化为CaSiO3,写出SiO2转化为CaSiO3的化学方程式_____________________。
②钾长石中的钾元素和铝元素在Na2CO3作用下转化为可溶性的NaAlO2和 KAlO2,写出Al2O3转化为NaAlO2的化学方程式____________________________。
(2)已知NaAlO2和KAlO2易发生如下反应:AlO2-+2H2O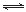 Al(OH)3+OH-。
Al(OH)3+OH-。
“浸取”时,应保持溶液呈______性(填“酸”或“碱”)。“浸取”时不断搅拌的目的是______________。
(3)“转化”时加入NaOH的主要作用是_______ (用离子方程式表示)。
(4)上述工艺中可以循环利用的主要物质是_______、_______和水。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某铜矿石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以此铜矿石为原料制备CuSO4·5H2O 及CaCO3,部分步骤如下:
请回答下列问题:
(1)溶液A除含有Cu2+外,还可能含有的金属离子有________(填离子符号),验证所含离子所用的试剂是______________。
(2)可用生成的CO2制取优质碳酸钙。制备时,先向氯化钙溶液中通入氨气,再通入CO2。
①实验室通常采用加热氯化铵和氢氧化钙混合物的方法制取氨气。某学习小组选取下图所给部分装置制取并收集纯净的氨气。
如果按气流方向连接各仪器接口,你认为正确的顺序为a→______、______→______、______→ i。其中与i相连漏斗的作用是______________。
②实验室中还可用固体氢氧化钠和浓氨水制取少量氨气,下列最适合完成该实验的简易装置是_________(填编号)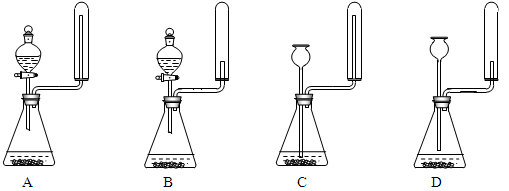
(3)测定铜矿石中Cu2(OH)2CO3质量百分含量的方法是:a.将1.25g铜矿石制取的CuSO4·5H2O于锥形瓶中,加入适量水完全溶解;b.向溶液中加入100mL0.25mol/L的氢氧化钠溶液使Cu2+完全沉淀;c.过滤;d.滤液中的氢氧化钠溶液用0.5mol/L盐酸滴定至终点,耗用10mL盐酸。则铜矿石中Cu2(OH)2CO3质量分数为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
现有苯甲酸、苯酚溶于乙醇所得的混合液,某同学设计方案分离三种物质,并检验其中的某些离子和物质。
已知:(1)酸性强弱:HCl>苯甲酸>H2CO3>苯酚> HCO3- (2)部分物理参数如下:
| | 密度 (g·mL-1) | 熔点 (℃) | 沸点 (℃) | 溶解性 |
| 苯甲酸 | 1.2659 | 122.13℃ | 249℃ | 微溶于水,易溶于乙醇、乙醚等有机溶剂 |
| 苯酚 | 1.07 | 40.6 | 181.9 | 易溶于乙醇、乙醚,65℃以上能与水互溶 |
| 乙醇 | 0.79 | -114.3 °C | 78.5 | 与水混溶,可混溶于醚、氯仿、甘油等多数有机溶剂 |

| 实验步骤 | 现象和结论 |
| ①取少量混合液1于试管,滴加________________________, 振荡,静置 | |
| ②取少量步骤①上层清夜于试管,滴加__________________ ____________________________________________________ | 澄清石灰水变浑浊 说明混合液1含有HCO3- |
| ③另取少量混合液1于试管,滴加___________________,振荡 | _________________________, 说明混合液1不含有酚羟基 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
实验室制备1,2-二溴乙烷的反应原理如下:
CH3CH2OH CH2=CH2+H2O
CH2=CH2+H2O
CH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚;浓硫酸把乙醇氧化为CO2等。
用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如下图所示: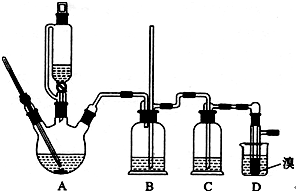
有关数据列表如下:
| | 乙醇 | 1,2-二溴乙烷 | 乙醚 |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g·cm3 | 0.79 | 2.2 | 0.71 |
| 沸点/oC | 78.5 | 132 | 34.6 |
| 熔点/oC | -130 | 9 | -116 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(16分)氨基甲酸铵(NH2COONH4)是一种白色固体,受热易分解。某小组模拟制备氨基甲酸铵,反应如下(且温度对反应的影响比较灵敏):2NH3(g)+CO2(g)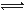 NH2COONH4(s) ΔH<0
NH2COONH4(s) ΔH<0
(1)如用下图I装置制取氨气,可选择的试剂是 。
(2)制备氨基甲酸铵的装置如下图Ⅱ所示,把NH3和CO2通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵的小晶体悬浮在CCl4中。 当悬浮物较多时,停止制备。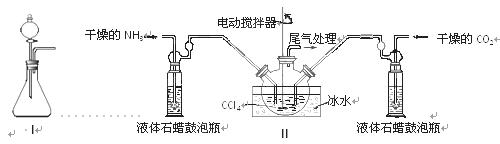
注:CCl4与液体石蜡均为惰性介质。
①发生器用冰水冷却的原因是_________________________________________,液体石蜡鼓泡瓶的作用是 。
②从反应后的混合物中分离出产品的实验方法是 (填写操作名称)。为了得到干燥产品,应采取的方法是________(填写选项序号)。
a.常压加热烘干 b.高压加热烘干 c.减压40℃以下烘干
(3)制得的氨基甲酸铵可能含有碳酸氢铵、碳酸铵中的一种或两种。
①设计方案,进行成分探究,请填写表中空格。
限选试剂:蒸馏水、稀HNO3、BaCl2溶液、澄清石灰水、AgNO3溶液、稀盐酸。
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量固体样品于试管中,加入蒸馏水至固体溶解。 | 得到无色溶液 |
| 步骤2:向试管中加入过量的BaCl2溶液,静置 | 若溶液不变浑浊,证明固体中不含碳酸铵。 |
| 步骤3:向试管中继续加入 。 | ,证明固体中含有碳酸氢铵。 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
氯化铁是常见的水处理剂,利用废铁屑可制备无水氯化铁。实验室制备装置和工业制备流程图如下: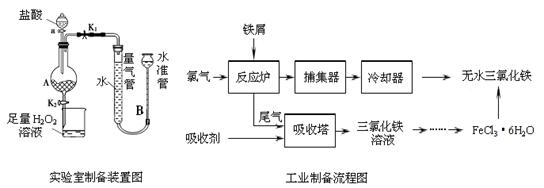
已知:(1)无水FeCl3的熔点为555 K、沸点为588 K。
(2) 废铁屑中的杂质不与盐酸反应
(3)不同温度下六水合氯化铁在水中的溶解度如下:
| 温度/℃ | 0 | 20 | 80 | 100 |
| 溶解度(g/100 g H2O) | 74.4 | 91.8 | 525.8 | 535.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com