
【题目】物质溶于水的过程中通常伴随着能量的变化,下表为四种物质的溶解热(“+”表示吸热,“-”表示放热)。
化学式 | NH4NO3 | NaOH | Ba(NO3)2 | KNO3 |
溶解热(kJ/mol) | +4.13 | -26.01 | + 1.57 | +3.49 |
将等物质的话的上述物质分别加入等质量的水中,所得溶液中水的离子积常数Kw最小的是
A. NH4NO3 B. NaOH C. KNO3 D. Ba(NO3)2
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. 氯气溶于水:Cl2+H2O![]() 2H++ClO-+Cl-
2H++ClO-+Cl-
B. 亚硫酸钠溶液被空气中的氧气氧化:SO32-+O2=SO42-
C. 氢氧化铁溶于氢碘酸中:Fe(OH)3+3H+=Fe3++3H2O
D. 碳酸氢铵溶液和足量的氢氧化钠溶液混合加热:NH4++HCO3-+2OH-![]() NH3↑+CO32-+2H2O
NH3↑+CO32-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
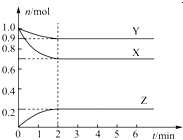
(1)该反应的化学方程式为____________。
(2)反应开始至2min,用气体Z表示的反应速率为____________。
(3)若X、Y、Z均为气体,反应达到平衡时:
①压强是开始时的____________倍;
②若此时将容器的体积缩小为原来的0.5倍,达到平衡时,容器内温度将降低(容器不与外界进行热交换),则该反应的正反应为________反应(填“放热”或“吸热”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】学习了元素周期律的知识后,同学们设计了多个实验探究元素性质的递变规律。
Ⅰ.甲组同学根据元素非金属性与对应最高价含氧酸之间的关系,选取C、Si、S三种非金属元素的常见化合物,设计了如图装置来一次性完成同主族和同周期元素非金属性强弱比较的实验研究。
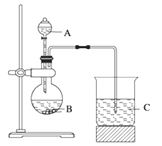
(1)甲组同学设计实验时,A中装H2SO4,则B,C中分别装
B____________________C__________________;
(2)烧杯C中发生反应的离子方程式 ____________________,
(3)通过实验得出的结论:元素非金属性强弱顺序为 ________________。(填元素符号)
Ⅱ.乙组同学认为利用图1装置可直接比较Cl2和S单质的氧化性强弱,他们选择的药品是浓盐酸,KMnO4固体, Na2S溶液。
(4)预计C中观察到的现象是__________________________________________________,
(5)C中反应的离子方程式为_____________________________________________________。
(6)有同学提出该装置存在明显缺陷需加以改进,你认为缺陷是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CCTV“科技博览”栏目报道,我国科学家首创以CO2为原料制备可降解塑料——聚二氧化碳。下列相关说法合理的是( )
A. 聚二氧化碳塑料属于高分子化合物
B. 聚二氧化碳塑料是无机化合物
C. 聚二氧化碳塑料中含有CO2分子
D. 使用聚二氧化碳塑料易造成环境污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)氯化硫(S2Cl2)是一种黄红色液体,有刺激性、窒息性恶臭,熔点为-80℃,沸点137.1℃。在空气中强烈发烟,易与水发生水解反应。人们使用它作橡胶硫化剂,使橡胶硫化,改变生橡胶热发粘冷变硬的不良性能。在熔融的硫中通入氯气即可生成S2Cl2。下图是实验室用S和Cl2制备S2Cl2的装置(夹持装置、加热装置均已略去)。
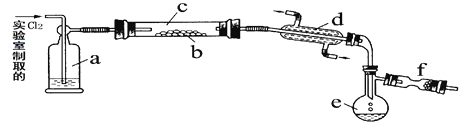
(1)已知S2Cl2分子结构与H2O2相似,请写出S2Cl2的电子式 。
(2)装置a中应放试剂为 ,其作用为 ;装置c为何水平放置 ;
(3)该实验的操作顺序应为 (用序号表示)。
①加热装置c ②通入Cl2③通冷凝水 ④停止通Cl2⑤停止加热装置c
(4)f装置中应放置的试剂为 ,其作用为 。
(5)已知S2Cl2水解时,只有一种元素的化合价发生了变化,且被氧化和被还原的该元素的物质的量之比为1:3,请写出该反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在固定的密闭容器内,一定温度下,可逆反应A2(g)+3B2(g)![]() 2AB3(g)达到平衡的标志是
2AB3(g)达到平衡的标志是
A.容器内每减少1mol A2,同时生成2mol AB3
B.容器内每减少1mol A2,同时生成1mol B2
C.容器内A2、B2、AB3的物质的量之比为1:3:2
D.容器内总压强保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学工业中会产生大带含铬废水,需进行无害化处理检测达标后才能排放。
(1)工业常用NaHSO3还原法处理,方法如下:向酸性废水中加入NaHSO3使Cr2O72- 还原成为Cr3+,然后加入熟石灰调节废水的pH,使Cr3+完全沉淀。
① 写出NaHSO3与Cr2O72-反应的离子方程式:__________________________________。
②已知25℃时Ksp[Cr(OH)3]=6.4×10-31。若除去废水中Cr3+,使其浓度小于1×10-5 molL-1,此时溶液中的c(H+)<_________molL-1
(2)废水中铬元素总浓度的测定方法如下:向一定量含Cr2O72-和Cr3+的酸性废水样中加入足量(NH4)2S2O8溶液将Cr3+氧化成Cr2O72-,煮沸除去过量的(NH4)2S2O8;再加入过量的KI溶液,Cr2O72-与I-完全反应后生成Cr3+和I2后,以淀粉为指示剂,用Na2S2O3标准溶液滴定至终点。测定过程中物质的转化关系如下:Cr3+ ![]() Cr2O72-
Cr2O72- ![]() I2
I2 ![]() S4O62-
S4O62-
①上述操作过程中,若无煮沸操作,则测定的铬元素总浓度会________(选填“偏大”、“偏小”或“不变”)。
②准确移取含Cr2O72-和Cr3+的酸性废水样100.00 mL,按上述方法测定废水样中铬元素总浓度,消耗0.01000 molL-1的Na2S2O3标准溶液13.50 mL。计算该废水中铬元素总浓度(以mg·L-1表示),写出计算过程。_____________________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com