
【题目】已知反应CO(g)+2H2(g)![]() CH3OH(g) ΔH=Q kJ·mol-1;在三个不同容积的容器中分别充入1 mol CO与2 mol H2,恒温恒容,测得平衡时CO的转化率如下表。下列说法正确的是
CH3OH(g) ΔH=Q kJ·mol-1;在三个不同容积的容器中分别充入1 mol CO与2 mol H2,恒温恒容,测得平衡时CO的转化率如下表。下列说法正确的是
温度(℃) | 容器体积 | CO转化率 | 平衡压强(p) | |
① | 200 | V1 | 50% | p1 |
② | 200 | V2 | 70% | p2 |
③ | 350 | V3 | 50% | p2 |
A.反应速率:③>①>②
B.平衡时体系压强:p1∶p2=5∶4
C.若容器体积V1>V3,则Q<0
D.若实验②中CO和H2用量均加倍,则CO转化率<70%
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
【题目】(1)将等径圆球在二维空间里进行排列,可形成密置层和非密置层,在图1所示的半径相等的圆球的排列中,A属于________层,配位数是________;B属于________层,配位数是________。
(2)将非密置层一层一层地在三维空间里堆积,得到如图2所示的一种金属晶体的晶胞,它被称为简单立方堆积,在这种晶体中,金属原子的配位数是________,平均每个晶胞所占有的原子数目是________。

(3)有资料表明,只有钋的晶体中的原子具有如图2所示的堆积方式,钋位于元素周期表的第________周期第__________族,元素符号是________,最外电子层的电子排布式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组用废旧镀锌铁皮按下列流程制备七水硫酸锌(ZnSO4·7H2O)

相关信息如下:
①金属离子形成氢氧化物沉淀的pH,如图A所示。
②ZnSO4的溶解度(物质在100g水中溶解的质量)随温度变化曲线如图B所示。

请回答:
(1)为提高镀锌铁皮中金属离子的浸出率,除了可适当增加硫酸的浓度,还可以采取的措施有:_______(任写一条)。
(2)步骤Ⅱ中需加入过量H2O2,请用离子方程式表示H2O2的作用________。
(3)步骤Ⅲ中调节pH范围为_______,调节pH宜选用的试剂为_______。
A.稀硫酸 B.氢氧化锌 C.氢氧化钠 D.氧化锌
(4)检验步骤Ⅲ所得滤液中是否含有Fe3+可采用的实验方法是_______。
(5)步骤Ⅳ需要用到下列所有操作:a.蒸发至溶液出现晶膜 b.在60℃蒸发溶剂 c.冷却至室温 d.在100℃蒸发溶剂 e.过滤
请给出上述操作的正确顺序______(操作可敢复使用)。
(6)步骤V中,某同学采用不同降温方式进行冷却结都,测得ZnSO4·7H2O颗粒大小分布如图所示。根据该实验结果,为了得到颗粒大小相对均的较大晶粒,宜选择______方式进行冷却结晶。
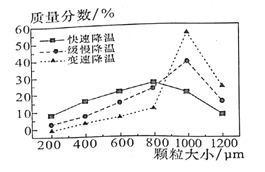
A.快速降温 B.级慢降温 C.变速降温
(7)ZnSO4可用于制备金属锌。用锌和高铁酸钾制成的高铁碱性电池,能储存比普通碱性电池多50%的电能,已知该电池的总反应是2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2。该电池正极反应式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向25℃时,体积均为20mL浓度均为0.1mol·L-1的两种酸HX、HY溶液中分別滴加0.1mol·L-1的NaOH溶液所加NaOH溶液体积与反应后溶液的pH的关系如图所示。下列叙述正确的是

A. HX、HY均为弱酸
B. Ka(HY)的数量级约为10-6
C. b点时:2c(Na+)=c(Y-)+c(HY)
D. V(NaOH)=20mL时,反应后的两种溶液中c(X-)=c(Y-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下的难溶电解质AmBn在水溶液中达到沉淀溶解平衡时,其平衡常数表达式为:Ksp=cm(An+)·cn(Bm-),称为难溶电解质的溶度积。已知25 ℃时,以下五种物质的Ksp:
物质 | AgCl | Ag2CrO4 | AgBr | AgI | Ag2S |
Ksp | 2×10-10 | 2×10-12 | 5.4×10-13 | 8.3×10-17 | 6.3×10-50 |
颜色 | 白色 | 砖红色 | 淡黄色 | 黄色 | 黑色 |
现以0.1 mol·L-1的AgNO3溶液测定某溶液中c(Cl-),适宜作滴定指示剂的物质是( )
A. K2CrO4 B. KBr C. KI D. K2S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种三室微生物燃料电池污水净化系统原理如图所示,图中有机废水中有机物可用C6H10O5,表示,咸水中的主要溶质为NaCl。下列有关说法正确的是

A. a为原电池的负极
B. b电极附近溶液的pH减小
C. a电极反应式为![]()
D. 中间室:Na+移向左室,Cl-移向右室
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钠是一种用途极广的强氧化剂,工业上可以用铬铁矿[主要成分为Fe(CrO2)2或FeO·Cr2O3,还含有Al2O3、Fe2O3、SiO2等杂质]制备,其主要工艺流程如图所示。请回答下列问题:

(1)煅烧铬铁矿生成Na2CrO4的化学方程式为______________________。
(2)调节溶液的pH所选的试剂为___________(填名称),写出生成Al(OH)3的化学方程式______________________。
(3)Na2CrO4溶液酸化时发生反应2CrO42-(黄色)+2H+![]() Cr2O72-(橙红色)+H2O。
Cr2O72-(橙红色)+H2O。
①该反应___________氧化还原反应(填“是”或“不是”),反应的平衡常数表达式:K=___________。
②若向Na2Cr2O7溶液(橙红色)中加入足量的NaOH固体,溶液___________(填标号)
A 变黄色 B 颜色不变 C 变红色溶液
③已知:25℃时,Ag2CrO4的Ksp=1.12×10-12,Ag2Cr2O7,的Ksp=2×10-7。25℃时,向Na2Cr2O7溶液中加入AgNO3溶液,生成砖红色沉淀,且溶液酸性增强,该沉淀的化学式是___________。
(4)用重铬酸钠(Na2Cr2O7)结晶后的母液生产重铬酸钾的反应为Na2Cr2O7+2KCl=K2Cr2O7+2NaCl,结合溶解度图回答,冷却结晶析出大量K2Cr2O7的原因是___________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四个反应
①2Na+2H2O=2NaOH+H2↑ ②2F2+2H2O=4HF+O2
③Cl2+H2O=HCl+HClO ④C+H2O(g)![]() CO+H2
CO+H2
试从氧化还原的角度,回答下列问题:
(1)水只作还原剂的是__________________(填序号)
(2)二氧化氯(ClO2)是一种在水处理方面有广泛应用的高效安全消毒剂,而且不会产生对人体有潜在危害的物质。工业上可以用如下方法制备ClO2:2NaClO3+H2O2+H2SO4=2ClO2↑+O2↑+Na2SO4+2H2O。反应中氧化剂是____________,生成1.25mol氧化产物共转移电子_________mol。写出该反应的离子方程式_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为二氧化锰的有关转化关系图,下列有关说法中不正确的是( )
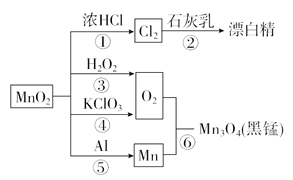
A. 反应①~⑥均属于氧化还原反应
B. 反应⑤中氧化剂与还原剂的物质的量之比为3∶4
C. 相同条件下生成等量的O2,反应③和④转移的电子数之比为1∶1
D. 反应①生成的Cl2经干燥后,可用钢瓶贮运
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com