
����Ŀ��ij��ȤС���÷Ͼɶ�п��Ƥ�����������Ʊ���ˮ����п(ZnSO4��7H2O)

�����Ϣ���£�
�ٽ��������γ��������������pH����ͼA��ʾ��
��ZnSO4���ܽ��(������100gˮ���ܽ������)���¶ȱ仯������ͼB��ʾ��

��ش�
��1��Ϊ��߶�п��Ƥ�н������ӵĽ����ʣ����˿��ʵ����������Ũ�ȣ������Բ�ȡ�Ĵ�ʩ�У�_______(��дһ��)��
��2�����������������H2O2���������ӷ���ʽ��ʾH2O2������________��
��3��������е���pH��ΧΪ_______������pH��ѡ�õ��Լ�Ϊ_______��
A��ϡ���� B��������п C���������� D������п
��4�����鲽���������Һ���Ƿ���Fe3+�ɲ��õ�ʵ�鷽����_______��
��5���������Ҫ�õ��������в�����a����������Һ���־�Ĥ b����60�������ܼ� c����ȴ������ d����100�������ܼ� e������
�����������������ȷ˳��______�������ɸҸ�ʹ��)��
��6������V�У�ijͬѧ���ò�ͬ���·�ʽ������ȴ�ᶼ�����ZnSO4��7H2O������С�ֲ���ͼ��ʾ�����ݸ�ʵ������Ϊ�˵õ�������С��Ծ��Ľϴ�������ѡ��______��ʽ������ȴ�ᾧ��
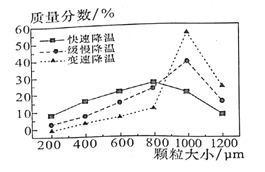
A�����ٽ��� B���������� C�����ٽ���
��7��ZnSO4�������Ʊ�����п����п��������Ƴɵĸ������Ե�أ��ܴ������ͨ���Ե�ض�50%�ĵ��ܣ���֪�õ�ص��ܷ�Ӧ��2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2���õ��������Ӧʽ��________��
���𰸡�����п��Ƥ�������Ȼ���� 2Fe2++H2O2+2H+=2Fe3++2H2O 3.8��pH<6.4 BD ȡ������Һ�������еμ�KSCN��Һ������Һ��Ϊ��ɫ����˵����Һ�к���Fe3+������ dabace C 2FeO42-+6e-+5H2O=Fe2O3+10OH-
��������
���������ͼ��֪����п��Ƥ�м���ϡ���ᣬп������ϡ���ᷴӦ��������п���������������˵õ���������п��������������Һ������Һ�м������˫��ˮ��˫��ˮ��������������Ϊ�����ӣ�����������п������п������ҺpHʹ������ת��Ϊ��������ȥ�����˵õ���������п����Һ����ͼB��֪�����������¶ȡ���ȴ�ᾧ�õ�������п���壻������п����ͨ���ؽᾧ���������ˮ����п���塣
��1��Ϊ��߶�п��Ƥ�н������ӵĽ����ʣ����˿��ʵ����������Ũ�ȣ������Բ�ȡ�������߷�Ӧ�¶ȡ������п��Ƥ�ͽ���ȴ�ʩ���ʴ�Ϊ������п��Ƥ�������Ȼ���裻
��2���������м������H2O2��Ŀ���ǽ�������������Ϊ�����ӣ���Ӧ�����ӷ���ʽΪ2Fe2++H2O2+2H+=2Fe3++2H2O���ʴ�Ϊ��2Fe2++H2O2+2H+=2Fe3++2H2O��
��3����ͼA��֪���������м���������п������п������Һ3.8��pH<6.4��ʹFe3+��ȫ�������ֲ�ʹZn2+�������ʴ�Ϊ��3.8��pH<6.4��BD��
��4��Fe3+��KSCN��Һ��Ӧ����Ѫ��ɫ�����軯����Һ�����鲽����������Һ���Ƿ���Fe3+Ӧѡ��KSCN��Һ����������Ϊȡ������Һ�������еμ�KSCN��Һ������Һ��Ϊ��ɫ����˵����Һ�к���Fe3+���������ʴ�Ϊ��ȡ������Һ�������еμ�KSCN��Һ������Һ��Ϊ��ɫ����˵����Һ�к���Fe3+��������
��5����ͼB��֪��Ҫ����Һ�еõ��ֲ�Ʒ�����ȼ���������ֱ�����־�Ĥ���ﵽ����״̬����ȥ�����ܼ�����60��ʱ��Ʒ���ܽ����ʽ�����60���������ܼ��������־�Ĥ���ﵽ����״̬��������ȴ�����£�ʹ��Ʒ�����������ˣ�ʹ��Һ���룬�õ��ֲ�Ʒ���ʲ�������ȷ˳��Ϊdabace���ʴ�Ϊ��dabace��
��6�����ͼ���֪�ڱ��ٽ��µ�����µõ��Ŀ����ϴ�ѡC���ʴ�Ϊ��C��
��7���ɵ���ܷ�Ӧ����ʽ��֪����������������Ϸŵ緢����ԭ��Ӧ����Fe2O3���缫��ӦʽΪ2FeO42-+6e-+5H2O=Fe2O3+10OH-���ʴ�Ϊ��2FeO42-+6e-+5H2O=Fe2O3+10OH-��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�0.1 mol/L H2A��Һ�д���H2A��HA��A2��������̬�����ӣ������ʵ���������(x)����ҺPH�仯�Ĺ�ϵ��ͼ��ʾ[��֪��(x)=c��X��/(C(H2A)+ C(HA��)+C(A2��))������˵������ȷ����(ͼ��a=1.35��b=4.17)

A. PH=7����Һ��C(Na+)=2[(C(A2��)+C(HA��)+C(H2A)]
B. 0.lmol/LNaHA��Һ��C(OH��)+C(A2��)=C(H+)+C(H2A)
C. ��֪Pka=��1gKa����Pka2=4.17
D. PH=3����Һ��C(HA��)>C(A2��)+C(H2A)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ݱ�����������ԱӦ�ü����ģ����ṹ����C60������N60����֪N60������ÿ����ԭ�Ӿ���N��N���������Nԭ�Ӷ��γ�8�����ȶ��ṹ����֪N��N������Ϊ159 kJ��mol��1���Իش��������⣺
(1)����������Ϣ�Ʋ�N60�Ľṹ�ص㣺________________��
(2)1 mol N60�ֽ��N2ʱ���ջ�ų���������____kJ��(��֪N��N�ļ���Ϊ946 kJ��mol��1)
(3)��(2)�о�N60��һЩ��;��______________________________________��
(4)��N60������ֻ��x������κ�y�������Σ���x��________��y��____________��(��֪���������У����������������������2)
(5)��NNN��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��ѧ��ӦA2(g)+ B2(g) �� 2AB(g)�������仯��ͼ��ʾ���ж�������������ȷ����

A��ÿ����2����AB����bkJ����
B������1molA��A��1molB��B�����ų�akJ����
C���÷�Ӧ�з�Ӧ��������������������������
D���÷�Ӧ�ȡ�H=+��a-b��kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʵ��С����һ����ѹ�ܱ������м���CH3OH��CO���壬������ӦCH3OH(g) + CO(g) ![]() CH3COOH(l)����֪��ij�¶��£��ﵽƽ��ʱ��CH3OH(g)��CO(g)��CH3COOH(l)�����ʵ����ֱ�Ϊ0.08mol��0.10mol��0.12mol��������������պ�Ϊ2L���������Ѵﵽƽ��ĺ�ѹ�����У�����˲��ͨ��0.12mol CH3OH��0.06molCO������壬ƽ����ƶ�����Ϊ
CH3COOH(l)����֪��ij�¶��£��ﵽƽ��ʱ��CH3OH(g)��CO(g)��CH3COOH(l)�����ʵ����ֱ�Ϊ0.08mol��0.10mol��0.12mol��������������պ�Ϊ2L���������Ѵﵽƽ��ĺ�ѹ�����У�����˲��ͨ��0.12mol CH3OH��0.06molCO������壬ƽ����ƶ�����Ϊ
A. ���� B. ���� C. ���ƶ� D. ��ȷ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�����X��Al2O3��Fe2O3��Cu��SiO2�е�һ�ֻ���������ɡ���������ʵ�飬�����й�˵����ȷ���ǣ� ��
![]()
A������I�м��ٵ�3g����һ���ǻ����
B������II���������ٵ�����һ����Cu
C�����ݲ���I��II�����жϻ����X�ijɷ�ΪAl2O3��Fe2O3��Cu��SiO2
D��������������II���Եó�m(Fe2O3)��m(Cu)=1��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У���������������ԭ�����͵���
A. ����ɫ��NO2����ѹ����ɫ�ȱ�����dz
B. ��ѹ�ȳ�ѹ�����ںϳ�SO3�ķ�Ӧ
C. ������������ڰ��ĺϳ�
D. ��ҵ��ȡ������Na(l)+KCl(l)![]() NaCl(l)+K(g)ѡȡ���˵��¶ȣ�ʹK��������ӷ�Ӧ������з������
NaCl(l)+K(g)ѡȡ���˵��¶ȣ�ʹK��������ӷ�Ӧ������з������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��ӦCO(g)+2H2(g)![]() CH3OH(g) ��H��Q kJ��mol-1����������ͬ�ݻ��������зֱ����1 mol CO��2 mol H2�����º��ݣ����ƽ��ʱCO��ת�������±�������˵����ȷ����
CH3OH(g) ��H��Q kJ��mol-1����������ͬ�ݻ��������зֱ����1 mol CO��2 mol H2�����º��ݣ����ƽ��ʱCO��ת�������±�������˵����ȷ����
�¶�(��) | ������� | COת���� | ƽ��ѹǿ(p) | |
�� | 200 | V1 | 50% | p1 |
�� | 200 | V2 | 70% | p2 |
�� | 350 | V3 | 50% | p2 |
A����Ӧ���ʣ�����������
B��ƽ��ʱ��ϵѹǿ��p1��p2��5��4
C�����������V1��V3����Q��0
D����ʵ������CO��H2�������ӱ�����COת���ʣ�70%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������A�Ļ�ѧʽΪNH5����������ԭ�ӵ�����㶼������Ӧ��ϡ������ԭ�ӵ��������Ӳ�ṹ���������й�˵���У�����ȷ����( )
A��1 mol NH5�к���5NA��N��H��(NA��ʾ�����ӵ�����)
B��NH5�м��й��ۼ��������Ӽ���NH5�����ӻ�����
C��NH5�ĵ���ʽΪ
D������ˮ��Ӧ�Ļ�ѧ����ʽΪNH5��H2O===NH3��H2O��H2��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com