
【题目】某密闭容器中的反应:3H2(g)+N2(g)![]() 2NH3(g)△H<0,其正反应速率随时间变化的情况如图所示,判断下列有关t1时刻条件变化的说法可能正确的是
2NH3(g)△H<0,其正反应速率随时间变化的情况如图所示,判断下列有关t1时刻条件变化的说法可能正确的是

A. 增大NH3浓度的同时减小N2浓度 B. 增大N2和H2的浓度
C. 扩大容器的体积 D. 降低反应温度
【答案】A
【解析】试题分析:A项增大NH3浓度的同时减小N2浓度瞬间会使逆反应速率增大,正反应速率减小,反应逆向移动,正反应速率逐渐增大达到平衡,新平衡下的正反应速率比原平衡大,故A项正确;B项增大N2和H2的浓度会瞬间增大正反应速率,逆反应速率不变,反应正向移动,正反应速率逐渐减小达到平衡,故B项错误;C项扩大容器的体积会使单位体积内该体系的分子总数减小,正逆反应速率同时减小,平衡应向使单位体积内分子数增多的方向移动,故平衡逆向移动,使正反应速率逐渐增大达到平衡,但新平衡下的正反应速率比原平衡小,故C项错误;D项该反应正向△H<0为放热反应,故降低温度正逆反应速率均减小,平衡正向移动,故正反应速率逐渐减小达到平衡,故D项错误;本题选A。


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】颠茄酸酯(J)是一种溃疡病治疗的辅助药物,其合成路线如下,回答下列问题:

(1)烃B其相对分子质量小于118,分子中氢的质量分数为7.69%,且反应I为加成反应,则X含有的官能团的名称是_______________。B的名称为_______________。
(2)反应3的反应类型为_______________。
(3)C的结构简式为_______________。
(4)写出D→E反应的化学方程式_______________。
(5)反应2的化学方程式为_______________。
(6)化合物I有多种同分异构体,同时满足下列条件的结构有______种。
①能发生水解反应和银镜反应;②能与FeCl3发生显色反应;
③苯环上有四个取代基,且苯环上一卤代物只有一种
(7)参照颠茄酸酯的合成路线,设计一条以 为起始原料制备
为起始原料制备 的合成路线。______________
的合成路线。______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】发射嫦娥三号的长征三号乙运载火箭,其中第3级火箭中的能源物质为液态H2和液态O2,发生的反应为2H2(g)+O2(g)===2H2O(g)。下列说法不正确的是( )

A. 化合反应都是放热反应
B. 2 mol气态H2与1 mol气态O2的总能量大于2 mol水蒸气的总能量
C. 断裂2 mol H—H键、1 mol O—O键吸收的总能量小于形成4 mol H—O键释放的总能量
D. 氢气燃烧过程中能量变化可用如图表示:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH将收制备高铁酸盐Na2FeO4的装置如图所示。下列推断合理的是

A. 镍是阳极,电极反应为4OH--4e-=O2↑+2H2O
B. 电解时电流的方向为:负极→Ni电极→溶液→Fe→电极→正极
C. 若隔膜为阴离子交换膜,则OH-自右向左移动
D. 电解时阳极区pH降低、阴极区pH升高(假设电解前后体积变化忽略不计)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,在盛有稀H2SO4的烧杯中放入用导线连接的电极X,Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( ) 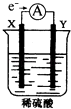
A.X极上发生的是还原反应
B.若两电极分别为Fe和碳棒,则Y为Fe
C.若反应进行一段时间后,产生2克H2时转移了1mol电子
D.溶液中的SO42﹣向X极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锡及其化合物在生产、生活中有着重要的用途。已知: Sn的熔点为231℃;Sn2+易水解、易被氧化;SnCl4极易水解、熔点为-33℃、沸点为114℃。请回答下列问题:
(1)元素锡比同主族碳的周期数大3,锡的原子序数为_________。
(2)用于微电子器件生产的锡粉纯度测定(已知锡的相对原子质量为119): ①取1.19g试样溶于稀硫酸中(杂质不参与反应),使Sn 完全转化为Sn2+;②加入过量的Fe2(SO4)3;③用0.1000mol/LK2Cr2O7溶液滴定(产物中Cr呈+3价),消耗20.00mL。步骤②中加入Fe2(SO4)3的作用是________;此锡粉样品中锡的质量分数为_________。若在滴定终点时俯视读数,则会导致测得的样品中锡的质量分数________(填“偏高“偏低”或“无影响”)。
(2)用于镀锡工业的硫酸亚锡(SnSO4)的制备路线如下:

①步骤I加入Sn粉的作用:____________及调节溶液pH。
②步骤II用到的玻璃仪器有烧杯、____________。
③步骤III生成SnO的离子方程式: ____________。
④步骤IV中检验SnO是否洗涤干净的操作是____________,证明已洗净。
⑤步骤V操作依次为____________ 、____________过滤、洗涤、低温干燥。
(4)实验室欲用下图装置制备少量SnCl4(夹持装置略),该装置存在明显缺陷,改进方法是____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着卤族元素原子半径的增大,下列递变规律正确的是
A. 单质的熔、沸点逐渐降低 B. 卤素离子的还原性逐渐增强
C. 气态氢化物稳定性逐渐增强 D. 单质的氧化性逐渐增强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com