
| 温度 | v(H2C2O4) | v(KMnO4) | KMnO4褪色时间 |
| 40℃ | 10mL | 10mL | 40s |
| 40℃ | 20mL | 20mL |
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| NaX | NaF | NaCl | NaBr | NaI |
| 熔点 | 995 | 801 | 775 | 651 |
| SiX4 | SiF4 | SiCl4 | SiBr4 | SiI4 |
| 熔点 | -90.2 | -70.4 | 5.2 | 120.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 铈、铬、钴、镍虽不是中学阶段常见的金属元素,但在工业生产中有着重要作用.
铈、铬、钴、镍虽不是中学阶段常见的金属元素,但在工业生产中有着重要作用.| 放电 |
| 充电 |
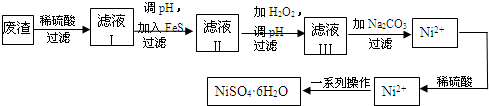
查看答案和解析>>
科目:高中化学 来源: 题型:
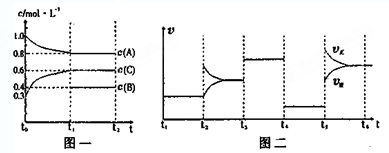
| t1-t2 | t2-t3 | t3-t4 | t4-t5 | t5-t6 |
| K1 | K2 | K3 | K4 | K5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示.电池正极的电极反应式是
有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示.电池正极的电极反应式是查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,48gO3气体含有NA个O3分子 |
| B、标准状况下,含4molHCl的浓盐酸与足量MnO2反应可生成22.4LCl2 |
| C、1L0.5mol?L-1Na2CO3溶液中含有0.5NA个CO32- |
| D、标准状况下,33.6LH2O含有1.5NA个H2O分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向NaHSO4溶液中加入过量的Ba(OH)2溶液:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
| B、向Fe(OH)3中加入过量的HI溶液:Fe(OH)3+3H+=Fe3++3H2O |
| C、用淀粉碘化钾试纸和盐酸检验加碘盐:IO3-+5I-+6H+=3I2+3H2O |
| D、将少量SO2气体通入足量的NaClO溶液中:SO2+ClO-+H2O=SO42-+Cl-+2H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com