硫酸是化学工业中的重要原料,我国已成为全球硫酸产能最高、产量最大的国家.
(1)18.4mol/L(质量分数0.98,密度1.84g/cm
3)浓硫酸是常用的干燥剂,用于吸收潮湿气体中的水蒸气.当浓硫酸浓度降到16mol/L(密度1.8g/cm
3)以下时,则失去干燥能力.
①16mol/L的硫酸的质量分数为
(保留两位小数,下同).
②50mL质量分数为0.98的浓硫酸作为干燥剂时,最多可吸水
g.
(2)将铁粉与硫粉在隔绝空气条件下反应所得的固体M 19.840g,与足量稀硫酸反应,收集到气体5.376L(换算到标准状况),质量为6.880g.则固体M的成分为
(写化学式),其中铁元素与硫元素的质量比为
.
(3)当代硫酸工业大多用接触法制硫酸(设空气中氧气的体积分数为0.20).
①为使黄铁矿煅烧充分,常通入过量40%的空气,则煅烧后炉气中SO
2的体积分数为
.
②将①中的炉气经净化除尘后直接送入接触室,流量为1.00m
3/s,从接触室导出气体的流量为0.95m
3/s(同温同压下测定),则SO
2的转化率为
%.
(4)接触法制硫酸排放的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的SO
2(循环利用)和混合铵盐.为测定此铵盐中氮元素的质量分数,将不同质量的铵盐分别加入到50.00mL相同浓度的NaOH溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解).该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量.
部分测定结果如下:
铵盐质量为10.000g和20.000g时,浓硫酸增加的质量相同;
铵盐质量为30.000g时,浓硫酸质量增重0.680g;
铵盐质量为40.000g时,浓硫酸的质量不变.
①计算该混合盐中氮元素的质量分数.
②计算上述氢氧化钠溶液的物质的量浓度.



 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案 将CH4和Cl2按体积比1:2混合充入大试管中,将此试管倒立在盛Na2SiO3溶液的水槽里,放在光亮处,如图所示下列描述正确的是( )
将CH4和Cl2按体积比1:2混合充入大试管中,将此试管倒立在盛Na2SiO3溶液的水槽里,放在光亮处,如图所示下列描述正确的是( ) 洋蓟在国际市场上属高档蔬菜,以良好的保健功能和药用价值被冠以“蔬之皇”的美称,从洋蓟提取的洋蓟素结构如图,请回答下列问题
洋蓟在国际市场上属高档蔬菜,以良好的保健功能和药用价值被冠以“蔬之皇”的美称,从洋蓟提取的洋蓟素结构如图,请回答下列问题 +A
+A
 元素周期表揭示了化学元素间的内在联系,使其构成了一个完整的体系.
元素周期表揭示了化学元素间的内在联系,使其构成了一个完整的体系.
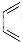 +
+ →G(抗病毒药阿昔洛韦中间体),G的结构简式为:
→G(抗病毒药阿昔洛韦中间体),G的结构简式为: