
 洋蓟在国际市场上属高档蔬菜,以良好的保健功能和药用价值被冠以“蔬之皇”的美称,从洋蓟提取的洋蓟素结构如图,请回答下列问题
洋蓟在国际市场上属高档蔬菜,以良好的保健功能和药用价值被冠以“蔬之皇”的美称,从洋蓟提取的洋蓟素结构如图,请回答下列问题 +A
+A| 催化剂 |
| 一定条件 |

 ,R为
,R为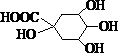 ,
, ,R为
,R为 ,
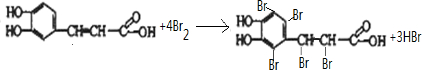
, 中苯环与碳碳三键发生加成反应,A物质的结构简式为
中苯环与碳碳三键发生加成反应,A物质的结构简式为 ,
, ,
, ;C=C、-OH、-COOH;
;C=C、-OH、-COOH; ;
; ,则R发生消去反应得产物的结构简式为
,则R发生消去反应得产物的结构简式为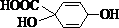 ,
, .
.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 如图所示的电解池I和Ⅱ中,a、b、c和d均为Pt电极.电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b>d.符合上述实验结果的盐溶液是( )
如图所示的电解池I和Ⅱ中,a、b、c和d均为Pt电极.电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b>d.符合上述实验结果的盐溶液是( )| 选项 | X | Y |
| A. | AgNO3 | Cu(NO3)2 |
| B. | MgSO4 | CuSO4 |
| C. | FeSO4 | Al2(SO4)3 |
| D. | CuSO4 | AgNO3 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、当A接外接电源负极时,Li+脱离离子存储层 |
| B、当A接外接电源正极时,电致变色层发生反应为:LiWO3-e-=WO3+Li+ |
| C、当B接外接电源负极时,膜的透射率降低,可以有效阻挡阳光 |
| D、该电致变色系统在较长时间的使用过程中离子导体层中Li+的量可保持基本不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH2=CH2+Br2→CH2BrCH2Br | ||||
B、 | ||||
C、C16H34
| ||||
| D、2CH3CH2OH+2Na→2CH3CH2ONa+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图,在半透膜袋里盛有淀粉的氯化钠溶液,将半透膜袋悬挂在蒸馏水中,回答下列问题:(知识支持:淀粉遇碘单质变蓝)
如图,在半透膜袋里盛有淀粉的氯化钠溶液,将半透膜袋悬挂在蒸馏水中,回答下列问题:(知识支持:淀粉遇碘单质变蓝)查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
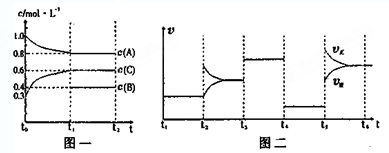
| t1-t2 | t2-t3 | t3-t4 | t4-t5 | t5-t6 |
| K1 | K2 | K3 | K4 | K5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com