
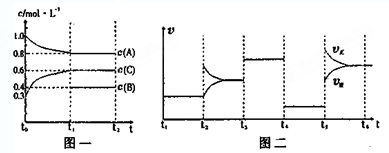
| t1-t2 | t2-t3 | t3-t4 | t4-t5 | t5-t6 |
| K1 | K2 | K3 | K4 | K5 |
| △c |
| △t |
 3C(g),起始2molA所对应的浓度为1mol/L,则体积应是2L,
3C(g),起始2molA所对应的浓度为1mol/L,则体积应是2L,| 0.6mol/L-0.3mol/L |
| 15min |
 3C(g),所以,△c(B)=
3C(g),所以,△c(B)=| 1 |
| 2 |
| 1 |
| 2 |
| 2mol |
| 1mol/L |
| C3(C) |
| C2(A)(B) |
| 0.63 |
| 0.82×0.4 |
 3C(g)△H=+200a kJ/mol,
3C(g)△H=+200a kJ/mol, 3C(g)△H=+200a kJ/mol.
3C(g)△H=+200a kJ/mol.


科目:高中化学 来源: 题型:
 洋蓟在国际市场上属高档蔬菜,以良好的保健功能和药用价值被冠以“蔬之皇”的美称,从洋蓟提取的洋蓟素结构如图,请回答下列问题
洋蓟在国际市场上属高档蔬菜,以良好的保健功能和药用价值被冠以“蔬之皇”的美称,从洋蓟提取的洋蓟素结构如图,请回答下列问题 +A
+A| 催化剂 |
| 一定条件 |

查看答案和解析>>
科目:高中化学 来源: 题型:
 )是一种重要的工业原料,某研究性学习小组的同学拟用下列装置制取高纯度的苯甲酸甲酯.
)是一种重要的工业原料,某研究性学习小组的同学拟用下列装置制取高纯度的苯甲酸甲酯.
| 熔点/℃ | 沸点/℃ | 密度/g?cm-3 | 水溶性 | |
| 苯甲酸 | 122.4 | 249 | 1.27 | 微溶 |
| 甲醇 | -97 | 64.3 | 0.79 | 互溶 |
| 苯甲酸甲酯 | -12.3 | 199.6 | 1.09 | 不溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度 | v(H2C2O4) | v(KMnO4) | KMnO4褪色时间 |
| 40℃ | 10mL | 10mL | 40s |
| 40℃ | 20mL | 20mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示,烧杯内盛有浓HNO3,在烧杯中放入用导线相连的铁、铅两个电极,已知原电池停止工作时,Fe、Pb都有剩余.试依次写出Fe电极上可能发生的电极反应式.
如图所示,烧杯内盛有浓HNO3,在烧杯中放入用导线相连的铁、铅两个电极,已知原电池停止工作时,Fe、Pb都有剩余.试依次写出Fe电极上可能发生的电极反应式.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、针对H7N9禽流感的扩散情况,要加强环境、个人等的消毒预防,可选用含氯消毒剂、活性银离子、酒精、双氧水等作为消毒剂,这种处理方法符合绿色化学核心 |
| B、肌红蛋白、蚕丝、过氧化氢酶、鱼油充分水解后均可得到氨基酸 |
| C、嫦娥三号月球车玉兔号在进入第二个月夜休眠前,出现了机构控制异常情况,其病因或为月尘,即月球上直径小于10微米的浮尘,月尘分散在空气中形成的分散系属于胶体 |
| D、某些铝硅酸盐形成的分子筛中有许多笼状空穴和通道,常用于分离、提纯气体或液体混合物,还可作干燥剂、离子交换剂、催化剂及催化剂载体等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、所有的蛋白质、多糖及油脂均可以水解 |
| B、氢键在形成蛋白质的二级结构和DNA的双螺旋结构中起着关键作用 |
| C、光导纤维、玻璃纤维和光电池板的主要成份均是二氧化硅 |
| D、为了减缓月饼等富脂食品变质,可在包装内放入小包装的还原铁粉 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com