

| ||
| ||
| ||


科目:高中化学 来源: 题型:
| A、CH2=CH2+Br2→CH2BrCH2Br | ||||
B、 | ||||
C、C16H34
| ||||
| D、2CH3CH2OH+2Na→2CH3CH2ONa+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| NaX | NaF | NaCl | NaBr | NaI |
| 熔点 | 995 | 801 | 775 | 651 |
| SiX4 | SiF4 | SiCl4 | SiBr4 | SiI4 |
| 熔点 | -90.2 | -70.4 | 5.2 | 120.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知:2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ?mol-1.恒温条件下,容积为1L的恒容容器中,硫可以发生如下转化,其反应过程和能量关系如图所示.
已知:2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ?mol-1.恒温条件下,容积为1L的恒容容器中,硫可以发生如下转化,其反应过程和能量关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
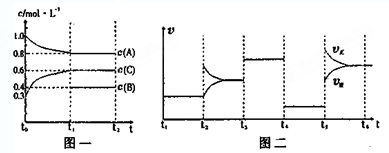
| t1-t2 | t2-t3 | t3-t4 | t4-t5 | t5-t6 |
| K1 | K2 | K3 | K4 | K5 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、正极发生的电极反应式为:H2-2e-=2H+ |
| B、通过灯泡的电流方向是从左到右 |
| C、该聚合物电解质薄膜可通过H+的定向迁移导电 |
| D、若将灯泡换成电解饱和食盐水装置,当燃料电池生成18克水时,电解食盐水会同时产生22.4L的H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com