
【题目】电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。
化学式 | 电离平衡常数(25℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
(1)25 ℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三种溶液的pH由大到小的顺序为__________________。
(2)25 ℃时,pH=3的CH3COOH溶液和pH=11的NaOH溶液混合,若所得溶液显酸性,则c(Na+)__________c(CH3COO-)(填“>”、“<”或“=”)。
(3)NaCN溶液中通入少量CO2,所发生反应的化学方程式为___________。
(4)25 ℃时, pH=8的CH3COONa溶液中,c(Na+)-c(CH3COO-)=___________。
【答案】Na2CO3溶液>NaCN溶液>CH3COONa溶液 < NaCN+H2O+CO2=HCN+NaHCO3 9.9x10-7 mol/L
【解析】
(1)根据酸的电离常数进行分析判断,电离常数越大,对应盐的水解程度越小,溶液的pH越小;
(2)根据溶液中电荷守恒分析比较;
(3)根据电离平衡常数H2CO3>HCN>HCO3-,结合复分解反应的规律书写方程式;
(4)根据溶液的pH可计算溶液中c(H+)、c(OH-),然后结合电荷守恒计算。
(1)根据图表数据分析,电离常数:CH3COOH>HCN>HCO3-,酸的电离平衡常数越小,其形成的钠盐越容易水解,溶液的碱性就越强。所以等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液水解程度为:Na2CO3溶液>NaCN溶液>CH3COONa溶液;
(2)25 ℃时,pH=3的CH3COOH溶液和pH=11的NaOH溶液混合,在该混合溶液中存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(CH3COO-),若所得溶液显酸性,则c(H+)>c(OH-),所以c(Na+)<c(CH3COO-);
(3)根据表格中的电离平衡常数H2CO3>HCN>HCO3-,可知向NaCN溶液中通入少量CO2,所发生反应的化学方程式为NaCN+H2O+CO2=HCN+NaHCO3;
(4)CH3COONa溶液溶液的pH=8,则溶液中c(H+)=10-8mol/L,c(OH-)=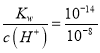 =10-6mol/L,在该混合溶液中存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(CH3COO-),则c(Na+)-c(CH3COO-)= c(OH-)-c(H+)=10-6mol/L-10-8mol/L=9.9×10-7 mol/L。
=10-6mol/L,在该混合溶液中存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(CH3COO-),则c(Na+)-c(CH3COO-)= c(OH-)-c(H+)=10-6mol/L-10-8mol/L=9.9×10-7 mol/L。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某矿石含碳酸镁和石英,制备高纯硅和硅胶的工艺流程如下:

(1)“硅胶”冶常用作_______________ ,也可以用作__________的载体。 A 的结构式为________。
(2)制备粗硅的方程式为_______。
(3)操作I为_____________,操作Ⅱ为_______________,操作Ⅲ所用仪器有铁架台(带铁圈)、酒精灯、_______________等。
(4)操作Ⅲ,需要在氯化氢气流中加热脱水的原因是_______________。
(5)溶液G用E酸化的方程式为_______________。
(6)电解饱和的K溶液的离子方程式为____________,阳极电极方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把0.1 molMnO2粉末加入50 mL过氧化氢的溶液里(密度为1.1 g·mL-1),在标准状况下,放出气体的体积V和时间t的关系曲线如图所示。

(1)实验时放出气体的体积为__________。
(2)放出一半气体所需的时间约为____________。
(3)根据曲线形状解释反应速率变化的原因________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铬和氢气在工业上都有重要的用途。已知:铬能与稀硫酸反应,生成氢气和硫酸亚铬(CrSO4)。铜铬构成原电池如图所示,盐桥中装的是饱和KCl琼脂溶液,下列关于此电池的说法正确的是

A.盐桥的作用是使整个装置构成通路、保持溶液呈电中性,凡是有盐桥的原电池,盐桥中均可以用饱和KCl琼脂溶液
B.理论上1molCr溶解,盐桥中将有2molCl-进入左池,2molK+进入右池
C.此过程中H+得电子,发生氧化反应
D.电子从铬极通过导线到铜极,又通过盐桥到转移到左烧杯中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下有0.1 mol·L-1四种溶液NaOH、 NH3·H2O、 HCl 、CH3COOH
(1)已知CH3COOH溶液的pH=3,其电离度为 ,由水电离的c(H+)= mol·L-1。
(2)相同pH的CH3COOH溶液和HCl溶液加水稀释,其pH变化情况如图,其中表示HCl溶液的是曲线 ,a、b两点中,导电能力更强的是 。
(3)NH3·H2O溶液和HCl溶液混合,已知体积V(NH3·H2O)> V(HCl),当溶液中c(NH3·H2O)= c(NH4+)时,溶液的pH= 。[已知:Kb(NH3·H2O)=1.77×10-5,lg 1.77=0.25]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下述实验中均有红棕色气体产生,对比分析所得结论不正确的是( )
|
|
|
① | ② | ③ |
A.由①中的红棕色气体,推断产生的气体一定是混合气体
B.红棕色气体不能表明②中木炭与浓硝酸发生了反应
C.由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D.③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B为单质,C为化合物,能实现上述转化关系的是( )
![]()
①若C溶于水后得到强碱溶液,则A可能是Na
②若C溶液遇Na2CO3放出CO2气体,则A可能是H2
③若C溶液中滴加KSCN溶液显红色,则B可能为Fe
④若C溶液中滴加NaOH溶液有蓝色沉淀生成,则B可能为Cu
A. ①② B. ①③ C. ②④ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于 下列结论正确的是
下列结论正确的是
A. 该有机物分子式为C13H16
B. 该有机物属于苯的同系物
C. 该有机物分子至少有4个碳原子共直线
D. 该有机物分子最多有13个碳原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是第三周期主族元素(11~17号)某些性质变化趋势的柱形图,下列有关说法中正确的是( )
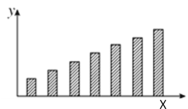
A. 若X轴为原子序数,y轴表示的可能是第一电离能
B. 若X轴为原子序数,y轴表示的可能是原子半径
C. 若X轴为最高正化合价,y轴表示的可能是电负性
D. 若X轴为族序数,y轴表示的可能是0.1mol/L最高价氧化物对应水化物溶液的pH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com