
【题目】把0.1 molMnO2粉末加入50 mL过氧化氢的溶液里(密度为1.1 g·mL-1),在标准状况下,放出气体的体积V和时间t的关系曲线如图所示。

(1)实验时放出气体的体积为__________。
(2)放出一半气体所需的时间约为____________。
(3)根据曲线形状解释反应速率变化的原因________________________。
【答案】60 mL 2 min 随着过氧化氢浓度的减小,化学反应速率减小
【解析】
(1)反应方程式为:2H2O2![]() 2H2O+O2↑,该反应为不可逆反应,根据图象可知生成的氧气的体积;
2H2O+O2↑,该反应为不可逆反应,根据图象可知生成的氧气的体积;
(2)反应放出气体体积为气体总体积一半为30mL,根据图象判断需要的时间;
(3)根据影响化学反应速率的因素进行分析解答。
(1)由反应方程式2H2O2![]() 2H2O+O2↑可知,该反应为不可逆反应,在4min后,收集到的气体体积不再增加,说明过氧化氢完全分解,由图象可知,生成氧气的体积为60mL,故答案为:60mL;
2H2O+O2↑可知,该反应为不可逆反应,在4min后,收集到的气体体积不再增加,说明过氧化氢完全分解,由图象可知,生成氧气的体积为60mL,故答案为:60mL;
(2)由图象可知,当时间进行到约为2min时,生成氧气的体积为30mL,此时生成的氧气为总体积的一半,需要的时间为2min,故答案为:2min;
(3) 浓度越大,反应速率越大,反之越小,随着反应进行,过氧化氢的浓度逐渐减小,则速率逐渐减小,故答案为:随着过氧化氢浓度的减小,化学反应速率减小。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】如图是铝的几种重要化合物之间的转化关系,下列表述不正确的是( )
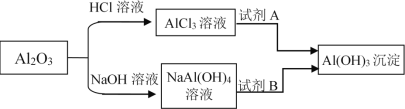
A.若加入的A是NaHCO3溶液,则生成沉淀的离子方程式为:Al3++3HCO3-=Al(OH)3↓+3CO2↑,溶液的pH增大
B.若加入的B是NaHCO3溶液,则生成沉淀的离子方程式为:Al(OH)4- + HCO3-=Al(OH)3↓+CO32-+H2O,溶液的pH减小
C.向AlCl3溶液中加入一定质量的Al(OH)3固体,一段时间后过滤,将所得固体洗涤干燥,称量,固体质量将增加
D.若加入的A是氨水、NaOH溶液或CH3COONa溶液等;或加入的B是NH4HCO3溶液、NH4Cl溶液或通入SO2、CO2气体等,均可析出Al(OH)3沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面所示是实验室制取SO2,并验证SO2的某些性质的装置图。试回答:
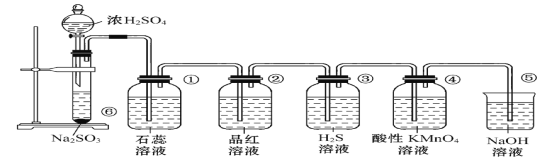
(1)②可证明SO2有___性;③可证明SO2有___性。
(2)④中的实验现象是__,证明SO2有___性。
(3)⑤的作用是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示反应N2(g)+3H2(g) ![]() 2NH3(g)+92.2kJ。在某段时间t0~t6中反应速率与反应过程的曲线图,则氨的百分含量最高的一段时间是( )
2NH3(g)+92.2kJ。在某段时间t0~t6中反应速率与反应过程的曲线图,则氨的百分含量最高的一段时间是( )
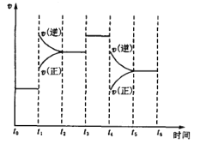
A.t0~t1B.t2~t3C.t3~t4D.t5~t6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
主族 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
四 | ⑨ | ⑩ |
(1)在③~⑦元素中,原子半径最大的是 ,其离子的原子结构示意图为
(2)元素的最高价氧化物对应的水化物中酸性最强的 ,碱性最强的是 ,呈两性的氢氧化物是 ;
(3)按要求写出下列两种物质的电子式:①的氢化物 ;⑨的最高价氧化物的对应的水化物 ;
(4)在⑦与⑩的单质中,化学性质较活泼的是 ,可用什么化学反应说明该事实(写出反应的化学方程式): 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述错误的是
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述错误的是
A.放电时正极附近溶液的碱性增强
B.放电时每转移3mol电子,正极有1molK2FeO4被还原
C.充电时锌极与外电源负极相连
D.充电时阳极反应为Fe(OH)3-3e-+H2OFeO42-+5H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究乙烯与溴的加成反应,甲同学设计并进行如下实验:先用乙醇和浓硫酸为原料制取乙烯(CH3CH2OH![]() CH2=CH2↑+H2O),将生成的气体直接通入溴水中,发现溶液褪色,即证明乙烯与溴水发生了加成反应。(已知:乙烯可以被浓硫酸氧化,有SO2生成)
CH2=CH2↑+H2O),将生成的气体直接通入溴水中,发现溶液褪色,即证明乙烯与溴水发生了加成反应。(已知:乙烯可以被浓硫酸氧化,有SO2生成)
乙同学发现在甲同学的实验中,产生的气体有刺激性气味,推测在制得的乙烯中还可能含有少量还原性的杂质气体,由此提出必须先除去杂质,再与溴水反应。
请你回答下列问题:
(1)甲同学设计的实验________(填“能”或“不能”)验证乙烯与溴水发生了加成反应,其理由是___________________。
A.使溴水褪色的反应,未必是加成反应
B.使溴水褪色的反应,就是加成反应
C.使溴水褪色的物质,未必是乙烯
D.使溴水褪色的物质,就是乙烯
(2)乙同学推测此乙烯中必定含有一种杂质气体是________,它与溴水反应的化学方程式是_________________。在验证过程中必须全部除去。为此,乙同学设计了如图所示的实验装置:

请回答:Ⅰ、Ⅱ、Ⅲ装置中可盛放的试剂是:Ⅰ________、Ⅱ________、Ⅲ________(填序号)。
A.品红 B.NaOH溶液
C.溴水 D.酸性高锰酸钾溶液
(3)为验证这一反应是加成反应而不是取代反应,丙同学提出可用pH试纸来测试反应后溶液的酸性,理由是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。
化学式 | 电离平衡常数(25℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
(1)25 ℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三种溶液的pH由大到小的顺序为__________________。
(2)25 ℃时,pH=3的CH3COOH溶液和pH=11的NaOH溶液混合,若所得溶液显酸性,则c(Na+)__________c(CH3COO-)(填“>”、“<”或“=”)。
(3)NaCN溶液中通入少量CO2,所发生反应的化学方程式为___________。
(4)25 ℃时, pH=8的CH3COONa溶液中,c(Na+)-c(CH3COO-)=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】优良的有机溶剂对孟烷和耐热型特种高分子功能材料PMnMA的合成路线如下:

已知:①芳香化合物苯环上的氢原子可被卤代烷中的烷基取代。如:
![]() +RX
+RX![]()
![]() +HX(R是烃基,X为卤原子)
+HX(R是烃基,X为卤原子)
②0.01 molC质量为1.08 g,能与饱和溴水完全反应生成3.45 g白色沉淀,E不能使Br2的CCl4溶液褪色。
③G的核磁共振氢谱有3种峰,其峰面积之比为3∶2∶1,G与Na2CO3溶液反应放出气体。
根据以上信息回答以下问题:
(1)化合物A的名称为______;C的结构简式为_______;C的名称为_______;
(2)下列说法正确的是_____(填选项字母)。
a.B可使酸性高锰酸钾溶液褪色
b.C不存在芳香族醛类同分异构体
c.D的酸性比E弱
d.F不能使溴水褪色
(3)①E与G反应生成H的化学方程式为__________;其反应类型为______。
②PMnMA的结构简式为_____,由H生成该有机物的反应类型为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com