

| A.C3H8中碳原子都采用的是sp3杂化 |
| B.O2、CO2、N2都是非极性分子 |
| C.每个N2中,含有2个π键 |
| D.CO的一种等电子体为NO+,它的电子式为[:N??O:]+ |
科目:高中化学 来源:不详 题型:填空题
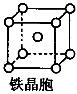
 3Na2O+2Fe+9N2↑。
3Na2O+2Fe+9N2↑。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
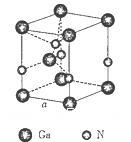
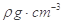 。列出计算氮化镓晶胞边长a的表达式:a=_______cm。
。列出计算氮化镓晶胞边长a的表达式:a=_______cm。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
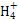 立体构型是 ,其中心原子的杂化方式为 。
立体构型是 ,其中心原子的杂化方式为 。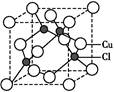
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 4NaCl+O2;2CaO+2Cl2
4NaCl+O2;2CaO+2Cl2 2CaCl2+O2;SiO2+2CCl4
2CaCl2+O2;SiO2+2CCl4 SiCl4+2COCl2;Cr2O3+3CCl4
SiCl4+2COCl2;Cr2O3+3CCl4 2CrCl3+3COCl2。
2CrCl3+3COCl2。
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.依据元素的原子序数,推断该元素原子的核外电子数 |
| B.依据原子最外层电子数的多少,推断元素金属性、非金属性的强弱 |
| C.依据气体的摩尔质量,推断相同状态下不同气体密度的大小 |
| D.依据液体物质的沸点,推断将两种互溶液态混合物用蒸馏法分离的可行性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 键的数目之比为 。
键的数目之比为 。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com