
【题目】有机化合物G可用来制备抗凝血药,可通过下列路线合成。
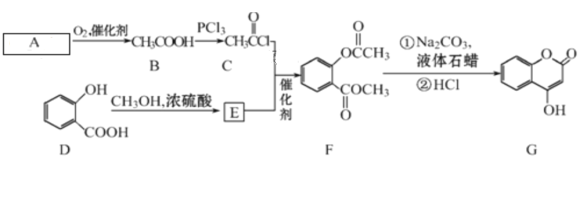
请回答:
(1)A 的结构简式________,在A→B的反应中,检验A是否反应完全的试剂为_________。
(2)C+E→F的反应类型是____,F中含有的官能团名称为________。
(3)写出G和过量NaOH溶液共热时反应的化学方程式____________。
(4)化合物E的同分异构体很多,符合下列条件的结构共有___种,①含苯环;②苯环上有两个取代基;③能与醇发生酯化反应;④不含-OCO-结构。所有同分异构体在下列某种表征仪器中显示的信号(或数据)完全相同,该仪器是___(填标号)。
a.质谱仪 b.红外光谱仪 c.元素分析仪 d.核磁共振仪
(5)已知酚羟基一般不易直接与羧酸酯化。苯甲酸苯酚酯(![]() )是一种重要的有机合成中间体。请根据已有知识并结合相关信息,试写出以苯酚、甲苯为原料制取该化合物的合成路线流程图(无机原料任选)_____。
)是一种重要的有机合成中间体。请根据已有知识并结合相关信息,试写出以苯酚、甲苯为原料制取该化合物的合成路线流程图(无机原料任选)_____。
【答案】CH3CHO 银氨溶液或新制氢氧化铜悬浊液 取代反应 酯基 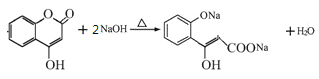 9 c
9 c 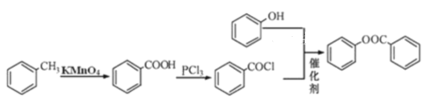
【解析】
根据流程可知,A与氧气在催化剂的条件下生成乙酸,则A为乙醛;邻羟基苯甲酸与甲醇在浓硫酸加热的条件下发生酯化反应,生成E,则E为邻羟基苯甲酸甲酯(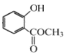 )。
)。
(1)分析可知,A为乙醛,其结构简式为CH3CHO;检验乙醛未完全反应时,则存在的官能团为醛基,可用银氨溶液或新制的氢氧化铜检验;
(2)已知E为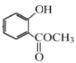 ,与C反应生成F,结合结构特点,反应类型为取代反应;F中含有的官能团为酯基;
,与C反应生成F,结合结构特点,反应类型为取代反应;F中含有的官能团为酯基;
(3)G中含有酯基,在NaOH溶液中酯基断裂,生成的酚羟基也能与NaOH反应,则方程式为![]() +2NaOH
+2NaOH![]()
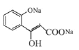
![]() H2O;
H2O;
(4)化合物E为 ,分子式为C8H8O3,其同分异构体①含苯环;②苯环上有两个取代基;③能与醇发生酯化反应,即含有羧基;④不含-OCO-结构,则苯环上的取代基为-OH、-CH2COOH;-CH2OH、-COOH;-OCH3、-COOH三组,各有邻、间、对三种,合计9种;
,分子式为C8H8O3,其同分异构体①含苯环;②苯环上有两个取代基;③能与醇发生酯化反应,即含有羧基;④不含-OCO-结构,则苯环上的取代基为-OH、-CH2COOH;-CH2OH、-COOH;-OCH3、-COOH三组,各有邻、间、对三种,合计9种;
a.质谱仪能记录分子离子、碎片离子的相对质量,质谱图中数值最大的即是该分子的相对分子质量,不符合题意,a错误;
b.红外光谱仪检测有机物中特殊官能团及机构特征,主要适用于定性分析有机化合物结构,不符合题意,b错误;
c.元素分析仪用于元素分析仪来确定有机化合物中的元素组成,符合题意,c正确;
d.核磁共振仪测出有机物中氢原子子的种类以及数目之比,不符合题意,d错误;
答案为c;
(5)根据流程可知,甲苯与酸性高锰酸钾反应生成苯甲酸,苯甲酸与PCl3反应生成![]() ,再与苯酚反应生成苯甲酸苯酚酯,流程为
,再与苯酚反应生成苯甲酸苯酚酯,流程为 。
。


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
【题目】某含![]() 的溶液中,可能还存在
的溶液中,可能还存在![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 六种离子中的一种或几种.进行以下实验
六种离子中的一种或几种.进行以下实验
①在原溶液中滴加足量氯水后,有气泡产生,溶液呈橙黄色;
②向橙黄色溶液中加入![]() 溶液时,无沉淀生成;
溶液时,无沉淀生成;
③橙黄色溶液不能使淀粉变蓝.
A.![]() 、
、![]() 、
、![]() B.
B.![]() 、
、![]() 、
、![]()
C.![]() 、
、![]() 、
、![]() D.
D.![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。制备流程如图所示:
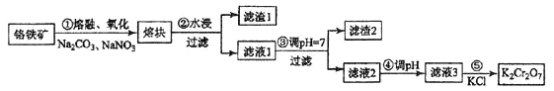
回答下列问题:
(1)步骤①的主要反应为:FeO·Cr2O3+Na2CO3+NaNO3![]() Na2CrO4+ Fe2O3+CO2+ NaNO2
Na2CrO4+ Fe2O3+CO2+ NaNO2
上述反应配平后FeO·Cr2O3与NaNO3的系数比为__________。该步骤不能使用陶瓷容器,原因是________________。
(2)滤渣1中含量最多的金属元素是____________,滤渣2的主要成分是_____________及含硅杂质。
(3)步骤④调滤液2的pH使之变____________(填“大”或“小”),原因是___________________(用离子方程式表示)。
(4)有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。冷却到___________(填标号)得到的K2Cr2O7固体产品最多。

a.80℃ b.60℃ c.40℃ d.10℃
步骤⑤的反应类型是___________________。
(5)某工厂用m1 kg 铬铁矿粉(含Cr2O3 40%)制备K2Cr2O7,最终得到产品 m2 kg,产率为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年1月3日上午,嫦娥四号探测器翩然落月,首次实现人类飞行器在月球背面的软着陆。所搭载的“玉兔二号”月球车,通过砷化镓(GaAs)太阳能电池提供能量进行工作。回答下列问题:
(1)基态As原子的价电子排布图为____________,基态Ga原子核外有________个未成对电子。
(2)镓失去电子的逐级电离能(单位:kJmol-1)的数值依次为577、1985、2962、6192,由此可推知镓的主要化合价为____和+3,砷的电负性比镓____(填“大”或“小”)。
(3)1918年美国人通过反应:HC≡CH+AsCl3![]() CHCl=CHAsCl2制造出路易斯毒气。在HC≡CH分子中σ键与π键数目之比为________;AsCl3分子的空间构型为___________。
CHCl=CHAsCl2制造出路易斯毒气。在HC≡CH分子中σ键与π键数目之比为________;AsCl3分子的空间构型为___________。
(4)砷化镓可由(CH3)3Ga和AsH3在700℃制得,(CH3)3Ga中碳原子的杂化方式为_______
(5)GaAs为原子晶体,密度为ρgcm-3,其晶胞结构如图所示, Ga与As以_______键键合。Ga和As的原子半径分别为a pm和b pm,设阿伏伽德罗常数的值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为_______________(列出计算式,可不化简)。
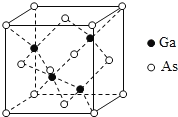
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白头翁素具有显著的抗菌作用,其合成路线如图所示:
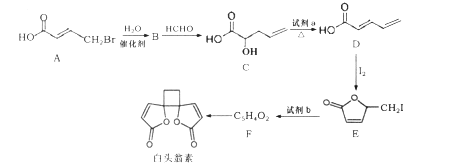
已知:
①RCH2Br![]() RCH=CHR’
RCH=CHR’
②2RCH=CHR’![]()
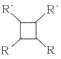
(以上R、R’代表氢、烷基)
(1)白头翁素的分子式为____。
(2)试剂a为______,E→F的反应类型为________。
(3)F的结构简式为_________。
(4)C中含有的官能团名称为________。
(5) A→B反应的化学方程式为_________。
(6)F与足量氢气加成得到G,G有多种同分异构体,其中属于链状羧酸类有____种。
(7)以乙烯为起始原料,选用必要的无机试剂合成 的路线为____(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
的路线为____(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中华人民共和国国家标准(GB2760-2011)规定葡萄酒中SO2最大使用量为0.25 g·L-1。某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定。


(1)仪器A的名称是_________,水通入A的进口为_________。
(2)B中加入300.00 mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为______________________________________________________。
(3)除去C中过量的H2O2,然后用0.090 0 mol·L-1NaOH标准溶液进行滴定,滴定前排气泡时,应选择图2中的_________;若滴定终点时溶液的pH=8.8,则选择的指示剂为_________;若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积(填序号)_________(①=10 mL,②=40 mL,③<10 mL,④>40 mL)。
(4)滴定至终点时,消耗NaOH溶液25.00 mL,该葡萄酒中SO2含量为_________g·L-1。
(5)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】B卷题.某兴趣小组为了提高电池的效率,设计了下图所示的原电池。
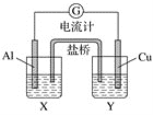
请回答下列问题:
(1)若X是AlCl3溶液,Y是稀硫酸,请你写出电极反应式和总反应式:
Al片上的电极反应式__________________________________,
Cu片上的电极反应式__________________________________,
总反应的方程式:________________________________________________。
(2)若X是浓硝酸,Y是NaCl溶液,请你写出电极名称及电极反应:
Al片上的电极反应式__________________________________,
Cu片上的电极反应式__________________________________,
总反应的方程式:________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己烯雌酚是一种激素类药物,结构如 ![]() 下列叙述中正确的是
下列叙述中正确的是
A. 分子中有7个碳碳双键,可以与氢气1:7加成
B. 该分子中有2个H,2个O,6个C共直线
C. 该分子对称性好,所以没有顺反异构
D. 该有机物分子中,最多可能有18个碳原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在甲、乙、丙三个恒温恒容的密闭容器中,分别加入足量活性炭和一定量的NO,进行反应C(s)+2NO(g)N2(g)+CO2(g),测得各容器中c(NO)随反应时间t的变化情况如表所示,下列说法正确的是( )
容器 度 | t/min c/mol·L-1 | 0 | 40 | 80 | 120 | 160 |
甲(400℃) | c(NO) | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
乙(400℃) | c(NO) | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
丙(T℃) | c(NO) | 2.00 | 1.40 | 1.10 | 1.10 | 1.10 |
A.达到平衡状态时,2v正(NO)=v逆(N2)
B.活性炭的质量不再改变不能说明反应已达平衡状态
C.丙容器中,从反应开始到建立平衡时的平均反应速率为v(NO)>0.01125mol·L-1·min-1
D.由表格数据可知:T<400℃
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com