
【题目】科学家对一碳化学进行了广泛深入的研究并取得了一些重要成果。
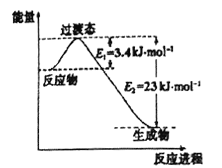
(1)目前工业上有一种方法是用CO2和H2在230℃催化剂条件下转化生成甲醇蒸汽和水蒸气。下图表示恒压容器中0.5molCO2和1.5molH2转化率达80%时的能量变化示意图。写出该反应的热化学方程式:__________________。
(2)现向三个体积均为2L的恒容密闭容器Ⅰ、Ⅱ、Ⅲ中均分别充入lmolCO和2molH2发生反应:CO(g)+2H2(g)![]() CH3OH(g) △H1=-90.1kJ/mol。三个容器的反应温度分别为T1、T2、T3且恒定不变,当反应均进行到5min时H2的体积分数如图所示,其中只有一个容器中的反应己经达到平衡状态.
CH3OH(g) △H1=-90.1kJ/mol。三个容器的反应温度分别为T1、T2、T3且恒定不变,当反应均进行到5min时H2的体积分数如图所示,其中只有一个容器中的反应己经达到平衡状态.

① 三个容器中一定达到平衡状态的是容器_____(填序号,下同)
②0~5min时间内容器I中用CH3OH表示的化学反应速率为__________。
③ 当三个容器中的反应均达到平衡状态时CO 的转化率最高的是容器_____;平衡常数最小的是容器______。
(3)CO常用于工业冶炼金属.右下图是在不同温度下CO还原四种金属氧化物达平衡后气体中lg[![]() ]与温度(t)的关系曲线图。下列说法正确的是_______。
]与温度(t)的关系曲线图。下列说法正确的是_______。
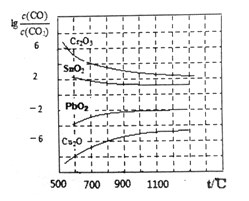
A.工业上可以通过增高反应装置来延长矿石和CO接触的时间,减少尾气中CO的含量
B.CO不适宜用于工业冶炼金属铬(Cr)
C.工业冶炼金属铜(Cu)时较低的温度有利于提高CO的利用率
D.CO还原PbO2的反应△H>O
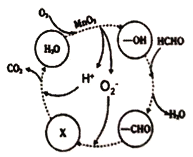
(4)某工厂工业废水中含有甲醛,该厂降解甲醛的反应机理如图所示,则X表示的粒子是____,总反应的化学方程式为_________。
【答案】 CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=-49kJ/mol Ⅲ 0.067 mol/(L·min) I Ⅲ BC( HCO3- ,HCHO+O2
CH3OH(g)+H2O(g) △H=-49kJ/mol Ⅲ 0.067 mol/(L·min) I Ⅲ BC( HCO3- ,HCHO+O2![]() CO2+H2O
CO2+H2O
【解析】(1)由恒压容器中0.5molCO2和1.5molH2转化率达80%时的能量变化示意图可知,0.5molCO2和1.5molH2转化率达80%时的能量变化为3.4kJ/mol-23kJ/mol=19.6kJ/mol,由此求出1molCO2和3molH2转化率达100%时的能量变化为49kJ/mol,所以该反应的热化学方程式为CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=-49kJ/mol。
CH3OH(g)+H2O(g) △H=-49kJ/mol。
(2)由图像可知,T3>T2>T1,所以反应前5min的平均速率为III>II>I,从速率方面讲,最先到达平衡状态的一定是III,由于该反应△H1<0为放热反应,该反应的化学平衡常数随温度升高而减小,所以从反应限度方面讲,最先到达平衡状态的也一定是III。
① 三个容器中一定达到平衡状态的是容器III。
②设0~5min时间内容器I中CO(g)+2H2(g)![]() CH3OH(g)氢气的转化率为x
CH3OH(g)氢气的转化率为x
起始量(mol) 1 2 0
变化量(mol) x 2![]() x
x
5min量(mol) 1- x 2-2x x
由氢气的体积分数为0.4=![]() ,解之得x=0.67,则用CH3OH表示的化学反应速率为
,解之得x=0.67,则用CH3OH表示的化学反应速率为![]() =0.067 mol/(L·min) 。
=0.067 mol/(L·min) 。
③ 当三个容器中的反应均达到平衡状态时,KI>KII>KIII,CO 的转化率最高的是容器I;平衡常数最小的是容器III。
(3)在平衡体系中,lg[![]() ]的值越小,说明反应的CO的转化率越高,金属氧化物越容易被还原,反之则越低,金属氧化物越难被还原。由达平衡后气体中lg[
]的值越小,说明反应的CO的转化率越高,金属氧化物越容易被还原,反之则越低,金属氧化物越难被还原。由达平衡后气体中lg[![]() ]与温度(t)的关系曲线图可知:A.工业上可以通过增高反应装置来延长矿石和CO接触的时间,减少尾气中CO的含量,这个说法不正确,在平衡状态下,CO的百分含量是保持不变的;B.由图可知,即使在1300℃,lg[
]与温度(t)的关系曲线图可知:A.工业上可以通过增高反应装置来延长矿石和CO接触的时间,减少尾气中CO的含量,这个说法不正确,在平衡状态下,CO的百分含量是保持不变的;B.由图可知,即使在1300℃,lg[![]() ]>2,
]>2, ![]() >102,则Cr2O3(s)+3CO(g)
>102,则Cr2O3(s)+3CO(g)![]() 2Cr(s)+3CO2(g),K=
2Cr(s)+3CO2(g),K=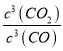 <10-6,所以CO不适宜用于工业冶炼金属铬(Cr)是正确的;C.由图可知,在较低的温度下,lg[
<10-6,所以CO不适宜用于工业冶炼金属铬(Cr)是正确的;C.由图可知,在较低的温度下,lg[![]() ]的值较小,所以工业冶炼金属铜(Cu)时较低的温度有利于提高CO的利用率是正确的;D.由图像可知,CO还原PbO2的反应中lg[
]的值较小,所以工业冶炼金属铜(Cu)时较低的温度有利于提高CO的利用率是正确的;D.由图像可知,CO还原PbO2的反应中lg[![]() ]的值随温度升高而增大,说明该反应的化学平衡常数随温度升高而减小,所以该反应为放热反应,△H<O ,D不正确。综上所述BC正确。
]的值随温度升高而增大,说明该反应的化学平衡常数随温度升高而减小,所以该反应为放热反应,△H<O ,D不正确。综上所述BC正确。
(4)由图可知,-CHO与O2-反应后生成X,而X与H+反应生成的是CO2,所以X表示的粒子是HCO3-,总反应的化学方程式为,HCHO+O2![]() CO2+H2O。
CO2+H2O。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】丙烯酸的结构简式为CH2=CH—COOH,对其性质的描述不正确的是( )
A.能与金属钠反应放出氢气B.能与新制氢氧化铜反应
C.能发生加聚反应生成高分子化合物D.能与溴水发生取代反应而使溴水褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,已知两瓶容积相同,同温同压下,左瓶内充满氯化氢气体,当右瓶中充满下列混合气体中的某一组时,其所含原子总数与左瓶中所含原子总数一定相等,则该混合气体是( )

A. O3、N2 B. CH4、NH3 C. N2、O2 D. CO、CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种短周期元素的部分性质数据如下:
元素 | T | X | Y | Z | W |
原子半径(nm) | 0.037 | 0.075 | 0.099 | 0.102 | 0.143 |
最高或最低化合价 | +1 | +5,-3 | +7,-1 | +6,-2 | +3 |
请回答下列问题:
(1)Z离子的结构示意图为________________。
(2)关于Y、Z两种元素,下列叙述正确的是________(填序号)
a.简单离子的半径Y>Z
b.气态氢化物的稳定性Y比Z强
c.最高价氧化物对应水化物的酸性Z比Y强
(3)甲是由T、X两种元素形成的10e-分子,乙是由Y、W两种元素形成的化合物。
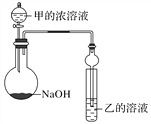
某同学设计了如图所示装置(夹持仪器省略)进行实验,将甲的浓溶液逐滴加入到NaOH固体中,烧瓶中立即有甲放出,原因是______________________。
一段时间后,观察到试管中的现象是______________________________,发生反应的离子方程式是______________________________________________。
(4)XO2是导致光化学烟雾的“罪魁祸首”之一。它被NaOH溶液吸收的化学方程式是:2XO2+2NaOH===M+NaXO3+H2O(已配平),产物M中元素X的化合价为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列填空
(1)决定物质体积的因素有 ①构成物质的粒子数;②粒子大小;③粒子间的距离。对固体、液体物质而言,它主要是由上述______决定(填写编号,下同);对气体物质而言,它主要由上述_____决定。
(2)标准状况下,体积为11.2 L 的CO2的 质量______g,其所含原子的总数是______ 个。
(3)配制100 mL2 molL-1的H2SO4溶液,需要某98%H2SO4溶液(密度为1.8g/cm-3)的体积为________ml(保留三位有效数字)。取配制后的溶液20ml,SO42-的物质的量为______,加入足量的锌,生成标况下氢气的体积为:______ L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铁溶液与氢氧化铁胶体具有的共同性质是 ( )
A. 分散质粒子大小都在1~100nm之间 B. 都有丁达尔效应
C. 分散质粒子都能通过滤纸 D. 都呈红褐色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方法正确的是是( )
A.用水鉴别四氯化碳、苯和乙醇
B.除去乙烷中少量的乙烯:通过酸性高锰酸钾溶液洗气
C.除去苯中少量的苯酚:加足量NaOH溶液,蒸馏
D.用碘水检验淀粉是否已经开始水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】月球上有颇为丰富的核聚变燃料He。有关He的说法正确的是( )
A. 原子序数为3 B. 中子数为3
C. 与He互为同位素 D. 核外电子数为3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com