
【题目】下列物质与其用途不完全符合的有( )
①干冰—人工降雨;②Na2CO3—制玻璃;③Fe2O3—红色油漆或涂料;④Al2O3—耐火材料;⑤NaClO—净水剂⑥NaHCO3—制食品发泡剂;⑦KAl(SO4)2—消毒、净水。
A.⑤⑦B.②④⑥⑧C.③④D.①③⑤⑦
【答案】A
【解析】
①干冰是固体的二氧化碳,干冰升华(由固态变成气态)时会吸收大量热,使空气中的水蒸气液化成水滴降落,就是人工降雨,①正确;
②制造玻璃的主要原料是碳酸钠、碳酸钙和二氧化硅,②正确;
③Fe2O3为红色固体,常用来作红色油漆或涂料,③正确;
④Al2O3熔点比较高,加热很难融化,可以用作耐火材料,④正确;
⑤次氯酸根离子水解生成次氯酸,次氯酸具有强的氧化性,能使蛋白质变性,因而能够杀菌消毒,不能净水,⑤错误;
⑥由2NaHCO3![]() Na2CO3+H2O+CO2↑可知,碳酸氢钠极易受热分解,生成碳酸钠,水和二氧化碳,生成的气体在面团里形成大量气泡,使得面团变得松软,所以碳酸氢钠可用于制食品发泡剂,⑥正确;
Na2CO3+H2O+CO2↑可知,碳酸氢钠极易受热分解,生成碳酸钠,水和二氧化碳,生成的气体在面团里形成大量气泡,使得面团变得松软,所以碳酸氢钠可用于制食品发泡剂,⑥正确;
⑦KAl(SO4)2电离的铝离子水解产生氢氧化铝,氢氧化铝表面积大,吸附力强,可以吸附水中悬浮的固体,使之形成沉淀,从而起到净水的作用,但不具有消毒功能,⑦错误;
可见物质与其用途不完全符合的有⑤⑦,故合理选项是A。


科目:高中化学 来源: 题型:
【题目】氮化锂(Li3N)是有机合成的催化剂,Li3N遇水剧烈反应。某小组设计实验制备氮化锂并测定其纯度,装置如图所示:
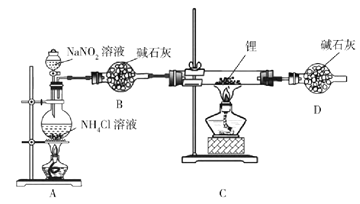
实验室用NH4Cl溶液和NaNO2溶液共热制备N2。
(1)盛装NH4Cl溶液的仪器名称是___________。
(2)安全漏斗中“安全”含义是__________。实验室将锂保存在_____(填“煤油”“石蜡油”或“水”)中。
(3)写出制备N2的化学方程式__________。
(4)D装置的作用是____________。
(5)测定Li3N产品纯度:取mg Li3N产品按如图所示装置实验。
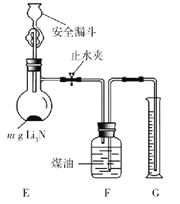
打开止水夹,向安全漏斗中加入足量水,当Li3N完全反应后,调平F和G中液面,测得NH3体积为VL(已折合成标准状况)。
①读数前调平F和G中液面的目的是使收集NH3的大气压________(填“大于”“小于”或“等于”)外界大气压。
②该Li3N产品的纯度为________%(只列出含m和V的计算式,不必计算化简)。若 Li3N产品混有Li,则测得纯度_____________(选填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学方程式书写错误的是( )
A.硅与氢氟酸反应:Si+4HF=SiF4↑+2H2↑
B.硅与烧碱溶液反应:Si+2NaOH+H2O=Na2SiO3+2H2↑
C.硅与盐酸反应:Si+4HCl=SiCl4+2H2↑
D.二氧化硅在高温下被C还原:SiO2+2C![]() Si+2CO↑
Si+2CO↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用右图所示的装置及药品进行酸性强弱比较的实验,下列说法不正确的是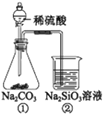
A.①和②中发生的反应均为复分解反应
B.向Na2SiO3饱和溶液中滴酚酞溶液无明显现象
C.一段时间后②中有胶冻状物质生成
D.该实验能证明酸性强弱的顺序是:硫酸>碳酸>硅酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)①常温下,pH=3的盐酸和pH=11的氢氧化钡等体积混合,溶液的pH=____。
②常温下pH=3的盐酸和pH=6的盐酸等体积混合(不考虑混合时溶液的体积变化),溶液的pH=____。(lg2=0.3)
(2)在某温度下,H2O的离子积常数为1×10-13,则该温度下:
①某溶液中的H+浓度为1×10-7mol/L,则该溶液呈___性。
②99mLpH=1的H2SO4溶液与101mLpH=12的KOH溶液混合后(不考虑混合时溶液的体积变化),溶液的pH=___。
(3)今有①CH3COOH、②HCl、③H2SO4三种溶液,用序号回答下列问题:
a.当它们pH相同时,其物质的量浓度由大到小排列是___。
b.当它们的物质的量浓度相同时,其pH由大到小排列是___。
c.中和同一烧碱溶液,需同浓度的三种酸溶液的体积关系为___。(用等式表示)
d.体积和浓度均相同的①、②、③三溶液,分别与同浓度的烧碱溶液恰好完全反应,反应需烧碱溶液的体积关系为___。(用等式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成氨与制备硝酸一般可连续生产,流程如下:
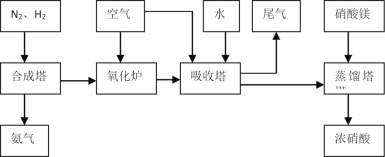
(1)工业生产时,制取氢气的一个反应为:CO(g)+H2O(g)![]() CO2(g)+H2(g)。
CO2(g)+H2(g)。
①t℃时,往1L密闭容器中充入0.2molCO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=___。
②保持温度不变,向上述平衡体系中再加入0.1molCO,当反应重新建立平衡时,水蒸气的总转化率α(H2O)=___。
(2)合成塔中发生反应为:N2(g)+3H2(g)![]() 2NH3(g) △H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1___573K(填“>”、“<”或“=”)。
2NH3(g) △H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1___573K(填“>”、“<”或“=”)。
T/K | T1 | 573 | T2 |
K | 1.00×107 | 2.45×105 | 1.88×103 |
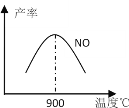
(3)NH3和O2在铂系催化剂作用下从145℃就开始反应:4NH3+5O2![]() 4NO+6H2O △H=-905kJ·mol-1 ,不同温度下NO产率如图所示。温度高于900℃时,NO产率下降的可能原因___。
4NO+6H2O △H=-905kJ·mol-1 ,不同温度下NO产率如图所示。温度高于900℃时,NO产率下降的可能原因___。
(4)吸收塔中反应为:3NO2+H2O![]() 2HNO3+NO。从生产流程看,吸收塔中需要补充空气,其原因是___。
2HNO3+NO。从生产流程看,吸收塔中需要补充空气,其原因是___。
(5)硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气。目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于某有机物的性质叙述不正确的是
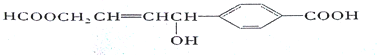
A. 1 mol该有机物完全燃烧可生成12molCO2
B. lmol该有机物分别与足量Na或NaHCO3反应,产生的气体分子数目相等
C. 1 mol该有机物可以与5mol H2发生加成反应
D. 1 mol该有机物可以与2 molNaOH发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合理利用或转化NO2、SO2、CO、NO等污染性气体是人们共同关注的课题。
Ⅰ.某化学课外小组查阅资料后得知:2NO(g)+O2(g)![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
①2NO(g)![]() N2O2(g)(快) v1正=k1正·c2(NO),v1逆=k1逆·c(N2O2) H1<0
N2O2(g)(快) v1正=k1正·c2(NO),v1逆=k1逆·c(N2O2) H1<0
②N2O2(g)+O2(g)![]() 2NO2(g)(慢) v2正=k2正·c(N2O2)·c(O2),v2逆=k2逆·c2(NO2) H2<0
2NO2(g)(慢) v2正=k2正·c(N2O2)·c(O2),v2逆=k2逆·c2(NO2) H2<0
请回答下列问题:

(1)反应2NO(g)+O2(g)![]() 2NO2(g)的H=________________(用含H1和H2的式子表示)。一定温度下,反应2NO(g)+O2(g)
2NO2(g)的H=________________(用含H1和H2的式子表示)。一定温度下,反应2NO(g)+O2(g)![]() 2NO2(g)达到平衡状态,写出用k1正、k1逆、k2正、k2逆表示平衡常数的表达式K=_____________________。
2NO2(g)达到平衡状态,写出用k1正、k1逆、k2正、k2逆表示平衡常数的表达式K=_____________________。
(2)决定2NO(g)+O2(g)![]() 2NO2(g)反应速率是反应②,反应①的活化能E1与反应②的活化能E2的大小关系为E1________E2(填“>”、“<”或“=”)。
2NO2(g)反应速率是反应②,反应①的活化能E1与反应②的活化能E2的大小关系为E1________E2(填“>”、“<”或“=”)。
Ⅱ.(3)反应N2O4(g)![]() 2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强有如下关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2·p2(NO2)。其中k1、k2是与温度有关的常数。一定温度下,相应的速率与压强关系如图所示,在图中标出的点中,能表示该反应达到平衡状态的两个点是_______________,理由是__________________________________________________________________________________________。
2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强有如下关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2·p2(NO2)。其中k1、k2是与温度有关的常数。一定温度下,相应的速率与压强关系如图所示,在图中标出的点中,能表示该反应达到平衡状态的两个点是_______________,理由是__________________________________________________________________________________________。
(4)在25℃时,将a mol·L-1的氨水溶液与0.02 mol·L-1 HCl溶液等体积混合后溶液恰好呈中性(忽略溶液混合后体积的变化),用含a的表达式表示250C时NH3·H2O的电离常数Kb=_________________。用质量分数为17%,密度为0.93 g/cm3的氨水,配制200 mL a mol·L-1的氨水溶液,所需原氨水的体积V=___________mL。
(5)如图电解装置可将雾霾中的NO、SO2分别转化为NH4+和SO42-。物质A的化学式为_________,阴极的电极反应式是__________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.等体积的CO2和CO,分子数目均为NA
B.常温下pH=12的NaOH溶液中,水电离出的氢离子数为10-12NA
C.标准状况下,22.4L的H2和22.4L的F2混合后,气体分子数为2NA
D.H2O(g)通过足量Na2O2(s)充分反应,固体增重bg时,反应中转移的电子数为bNA/2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com