
【题目】化学反应A2+B2 =2AB的能量变化如图所示。下列说法正确的是( )
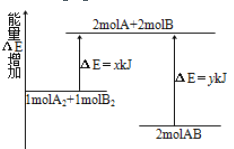
A. 该反应是吸热反应
B. 2 mol A—B键断裂需要吸收y kJ 的能量
C. 1 mol A—A键和1mol B—B键断裂能放出x kJ的能量
D. 2 mol AB的总能量高于1 mol A2和1 mol B2的总能量
科目:高中化学 来源: 题型:
【题目】正在研制的一种“高容量、低成本”锂——铜空气燃料电池。该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法不正确的是( )
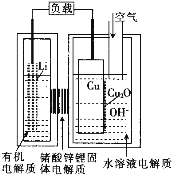
A.通空气时,铜被腐蚀,表面产生CuO
B.放电一段时间后右侧水溶液电解质中LiOH浓度逐渐增大
C.放电时,正极的电极反应式为Cu2O+H2O+2e-=2Cu+2OH-
D.整个反应过程中,铜相当于催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲进行下列实验,其方案设计合理的是
A | B | C | D |
检验装置气密性 | 制过氧化钠 | 验证浓H2SO4的脱水性、强氧化性 | 比较NaHCO3和Na2CO3溶解度 |
|
|
|
|
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填写下列空格。
(1)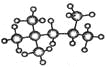 的分子式为:_____________,其一氯代物有_____种,该烃有多种同分异构体,其中有一种一氯取代物只有一种,写出这种同分异构体的结构简式:_____
的分子式为:_____________,其一氯代物有_____种,该烃有多种同分异构体,其中有一种一氯取代物只有一种,写出这种同分异构体的结构简式:_____
(2)分子式为C6H14的烃的主链为4个碳的同分异构体共有______种。
(3)写出实验室制取硝基苯的化学方程式:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有以下物质相互转化:
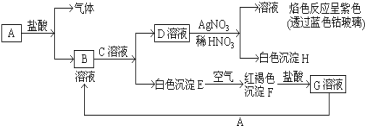
(1)写出下列各物质的化学式:
A___,B____,D___,F___,G___。
(2)写出由E转变成F的化学方程式___。
鉴别溶液G的试剂是__,现象___。
(3)G溶液和A反应的离子方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应①2F2+2H2O=4HF+O2↑;②AlCl3+3NaHCO3=Al(OH)3↓+3NaCl+3CO2↑ ;③2Na+2H2O=2NaOH+H2↑;④SO2+H2O=H2SO3⑤SO2+Cl2+2H2O=H2SO4+2HCl;⑥NaH+H2O=NaOH+H2↑;⑦CO+H2O![]() CO2+H2;⑧3NO2+H2O = 2HNO3+NO
CO2+H2;⑧3NO2+H2O = 2HNO3+NO
(1)上述反应中不属于氧化还原反应的有(填序号,下同)_____________
(2)H2O被氧化的是_____________;属于氧化还原反应,但H2O既不被氧化,也不被还原的是_____________。
(3)写出⑤的离子反应方程式_____________。
(4)用双线桥法表示反应⑧中电子转移的方向和数目,并指出氧化产物和还原产物。双线桥法:_____________;氧化产物:_____________;还原产物:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用“银-Ferrozine”法测室内甲醛含量的原理如下:
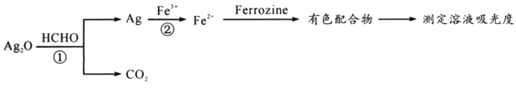
下列有关说法正确的是
A.HCHO和CO2都是既含有σ键又含有π键的非极性分子
B.反应①的化学方程式为2Ag2O+HCHO=4Ag+CO2↑+H2O
C.理论上,吸收的HCHO与消耗的Fe3+的物质的量之比为1:4
D.每生成1.12LCO2时,反应②中一定对应生成11.2gFe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】半导体工业会产生含氢氟酸的废水。回答下列问题:
(1)为了测定某含氢氟酸的废水中HF浓度,量取25.00mL废水,滴入2~3滴酚酞试液,用0.0100molL-1NaOH标准溶液滴定,用去27.00mL。滴定终点的判断方法是____________;废水中的c(HF)=__________________molL-1 (精确到0.0001)。
(2)用石灰乳处理含氢氟酸的废水时,会得到含氟底泥(主要含CaF2、CaCO3、CaSO4)。含氟底泥可用于制取氟化钙,其生产流程如下:
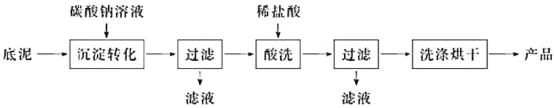
已知:氟化钙难溶于水,微溶于无机酸。
①“沉淀转化”的目的是将CaSO4转化为CaCO3。从平衡移动的角度分析,沉淀能够转化的原理是____________________________。
②最终得到的产品质量比底泥中CaF2的质量少,其原因是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理对于消除环境污染有重要意义。回答下列问题:
(1)NO2和N2O4以物质的量之比为1:1与O2和H2O恰好完全反应的化学方程式为_____。
(2)已知:2N2O5(g)![]() 2N2O4(g)+O2(g) H=-4.4kJ/mol
2N2O4(g)+O2(g) H=-4.4kJ/mol
N2O5(g)![]() 2NO2(g)+
2NO2(g)+![]() O2(g) H =+53.1 kJ/mol
O2(g) H =+53.1 kJ/mol
则反应2NO2(g)![]() N2O4(g)的H=___kJ/mol。
N2O4(g)的H=___kJ/mol。
(3)利用现代手持技术传感器可以探究压强对2NO2(g)![]() N2O4(g)化学平衡移动的影响。在恒定温度和标准压强(100kPa)条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、t2时刻迅速移动活塞后并保持活塞位置不变(不考虑温度的变化)。测定针筒内气体压强变化如图所示:
N2O4(g)化学平衡移动的影响。在恒定温度和标准压强(100kPa)条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、t2时刻迅速移动活塞后并保持活塞位置不变(不考虑温度的变化)。测定针筒内气体压强变化如图所示:
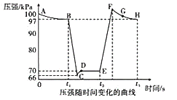
①B点时NO2的转化率为___;B点反应N2O4![]() 2NO2(g)的平衡常数Kp为____(Kp为以分压表示的平衡常数,计算结果保留1位小数)。
2NO2(g)的平衡常数Kp为____(Kp为以分压表示的平衡常数,计算结果保留1位小数)。
②B、E两点对应的正反应速率大小为νB___νE(请填“>”“<”或“=”)。
③E、F、G、H四点时对应气体的平均相对分子质量最大的点为___。
(4)反应物NO2可由2NO(g)+O2(g)![]() 2NO2生成,对该反应科学家提出如下反应历程:
2NO2生成,对该反应科学家提出如下反应历程:
第一步NO+NO![]() N2O2 快速平衡
N2O2 快速平衡
第二步N2O2+O2→2NO2 慢反应
下列说法正确的是_____(填标号)。
A.若第一步放热,温度升高,总反应速率可能减小
B.N2O2为该反应的催化剂
C.第二步反应的活化能比第一步反应的活化能大
D.第二步中N2O2与O2的碰撞100%有效
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com