
【题目】氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理对于消除环境污染有重要意义。回答下列问题:
(1)NO2和N2O4以物质的量之比为1:1与O2和H2O恰好完全反应的化学方程式为_____。
(2)已知:2N2O5(g)![]() 2N2O4(g)+O2(g) H=-4.4kJ/mol
2N2O4(g)+O2(g) H=-4.4kJ/mol
N2O5(g)![]() 2NO2(g)+
2NO2(g)+![]() O2(g) H =+53.1 kJ/mol
O2(g) H =+53.1 kJ/mol
则反应2NO2(g)![]() N2O4(g)的H=___kJ/mol。
N2O4(g)的H=___kJ/mol。
(3)利用现代手持技术传感器可以探究压强对2NO2(g)![]() N2O4(g)化学平衡移动的影响。在恒定温度和标准压强(100kPa)条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、t2时刻迅速移动活塞后并保持活塞位置不变(不考虑温度的变化)。测定针筒内气体压强变化如图所示:
N2O4(g)化学平衡移动的影响。在恒定温度和标准压强(100kPa)条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、t2时刻迅速移动活塞后并保持活塞位置不变(不考虑温度的变化)。测定针筒内气体压强变化如图所示:
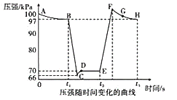
①B点时NO2的转化率为___;B点反应N2O4![]() 2NO2(g)的平衡常数Kp为____(Kp为以分压表示的平衡常数,计算结果保留1位小数)。
2NO2(g)的平衡常数Kp为____(Kp为以分压表示的平衡常数,计算结果保留1位小数)。
②B、E两点对应的正反应速率大小为νB___νE(请填“>”“<”或“=”)。
③E、F、G、H四点时对应气体的平均相对分子质量最大的点为___。
(4)反应物NO2可由2NO(g)+O2(g)![]() 2NO2生成,对该反应科学家提出如下反应历程:
2NO2生成,对该反应科学家提出如下反应历程:
第一步NO+NO![]() N2O2 快速平衡
N2O2 快速平衡
第二步N2O2+O2→2NO2 慢反应
下列说法正确的是_____(填标号)。
A.若第一步放热,温度升高,总反应速率可能减小
B.N2O2为该反应的催化剂
C.第二步反应的活化能比第一步反应的活化能大
D.第二步中N2O2与O2的碰撞100%有效
【答案】4NO2+4N2O4+3O2+6H2O=12HNO3 -55.3 6% 3036.4 > H AC
【解析】
(1)NO2和N2O4以物质的量之比为1:1与O2和H2O恰好完全反应,反应中氧气为氧化剂,化合价由0价变为-2价,氮元素化合价应升高被氧化,则为+5价,化合价升(1+1×2)×(5-4)=3,降为2×2=4,最小公倍数为12,结合质量守恒可得化学方程式为4NO2+4N2O4+3O2+6H2O=12HNO3;
(2)已知:①2N2O5(g)![]() 2N2O4(g)+O2(g) H1=-4.4kJ/mol
2N2O4(g)+O2(g) H1=-4.4kJ/mol
②N2O5(g)![]() 2NO2(g)+
2NO2(g)+![]() O2(g) H2=+53.1 kJ/mol
O2(g) H2=+53.1 kJ/mol
根据盖斯定律,由①×![]() -②得反应2NO2(g)
-②得反应2NO2(g)![]() N2O4(g) H=-4.4kJ/mol×
N2O4(g) H=-4.4kJ/mol×![]() -53.1 kJ/mol=-55.3 kJ/mol;
-53.1 kJ/mol=-55.3 kJ/mol;
(3)①根据阿伏加德罗定律,温度,体积不变时,压强之比等于物质的量之比,设起始时NO2的物质的量为n,反应的物质的量为2x,列出三段式:
2NO2(g)![]() N2O4(g)
N2O4(g)
起始/mol n 0
反应/mol 2x x
平衡/mol n-2x x
气体物质的量之比等于压强之比,则![]() =
=![]() ,x=
,x=![]() ,NO2的转化率为
,NO2的转化率为![]() ×100%=
×100%=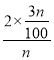 ×100%=6%;n-2x=n-2×
×100%=6%;n-2x=n-2×![]() =
=![]() ,n-2x+x=
,n-2x+x=![]() ,则B点反应N2O4
,则B点反应N2O4![]() 2NO2(g)的平衡常数Kp为
2NO2(g)的平衡常数Kp为 =3036.4;
=3036.4;
②压强影响气体的化学反应速率,压强增大,化学反应速率加快,B点的压强大于E点的压强,则νB>νE;
③t2时刻移动了活塞,压强迅速增大,说明针筒内体积缩小,保持活塞位置不变后,平衡向着正向移动,混合气的物质的量逐渐减小,根据M=![]() ,可知,E、F、G、H四点时对应气体的平均相对分子质量最大的点为H;
,可知,E、F、G、H四点时对应气体的平均相对分子质量最大的点为H;
(4)A.若第一步放热,温度升高,平衡逆向移动,使第二步N2O2的量减少,总反应速率可能减小,选项A正确;
B.N2O2为该反应的中间产物,不是催化剂,选项B错误;
C.降低活化能,可加快反应速率,则第二步的活化能比第一步的高,选项C正确;
D.第二步反应较慢,则有效碰撞的次数较少,可知N2O2与O2的碰撞不可能100%有效,选项D错误。
答案选AC。


科目:高中化学 来源: 题型:
【题目】化学反应A2+B2 =2AB的能量变化如图所示。下列说法正确的是( )
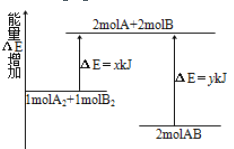
A. 该反应是吸热反应
B. 2 mol A—B键断裂需要吸收y kJ 的能量
C. 1 mol A—A键和1mol B—B键断裂能放出x kJ的能量
D. 2 mol AB的总能量高于1 mol A2和1 mol B2的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是
A. 将1mol Cl2通入足量水中,溶液中HC1O、Cl-、ClO-粒子数之和为2NA
B. 100g CaCO3晶体和100g KHSO4晶体中含有的离子数分别为2NA和3NA
C. 标准状况下,4.48L NO和2.24L O2混合后,原子总数为0.6NA
D. 已知3BrF3 + 5H2O=HBrO3 + Br2 + 9HF + O2↑,若有5mol H2O参加反应,则被水还原的BrF3分子数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种废料的主要成分是铁镍合金,还含有铜、钙、镁、硅的氧化物,由该废料制备的纯度较高的氢氧化镍,工艺流程如下,已知常温下Ksp[Ni(OH)2]=1.0×10-15,则下列说法错误的是( )
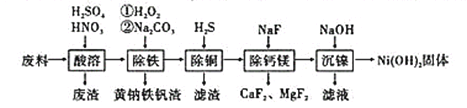
A. 废渣中含有二氧化硅和硫酸钙
B. 加热煮沸可以提高除铁效率
C. 除铜过程中,溶液酸性增强
D. “沉镍”过程中为了将镍沉淀完全,需要调节pH>9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验装置或操作进行的相应实验,能达到实验目的的是

A. 用图甲所示装置分离乙醇和碘的混合液
B. 用图乙所示操作配制100 mL 0.1 mol·L-1硫酸溶液
C. 用图丙所示装置制备氨气
D. 用图丁所示装置检验浓硫酸与蔗糖反应产生的二氧化硫
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.5 L某浓度的NaCl溶液中含有0.5 mol NaCl,下列对该溶液的说法中,不正确的是
A. 该溶液溶质的物质的量浓度为1 mol·L-1
B. 该溶液中含有58.5 g NaCl
C. 配制100 mL该溶液需用5.85 g NaCl
D. 量取100 mL该溶液倒入烧杯中,烧杯中的NaCl物质的量为0.1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关仪器的使用或实验操作正确的是
A.用稀盐酸洗涤H2还原CuO后试管内壁的铜
B.蒸发时,蒸发皿中溶液的量不能超过总容量的![]()
C.分离苯萃取溴水后的分层液体,从分液漏斗下口先放出水层,再放出有机层
D.用KMnO4溶液测定Na2C2O4的浓度时,KMnO4溶液盛放在碱式滴定管中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某条件下,合成氨反应的数据如下:
N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
起始浓度/mol·L-1 1.0 3.0 0.2
2s末浓度/mol·L-1 0.6 1.8 1.0
4s末浓度/mol·L-1 0.4 1.2 1.4
当用氨气浓度的增加来表示该反应的速率时,下列说法中错误的是 ( )
A. 2s末氨气的反应速率=0.4mol·(L·s)-1
B. 前2s时间内氨气的平均反应速率=0.4mol·(L·s)-1
C. 前4s时间内氨气的平均反应速率=0.3mol·(L·s)-1
D. 2~4s时间内氨气的平均反应速率=0.2mol·(L·s)-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:![]() 。下列有关物质的推断不正确的是
。下列有关物质的推断不正确的是
A. 若甲为Cl2,则丁可能是铁B. 若甲为NH3,则丁可能是氧气
C. 若甲为AlCl3溶液,则丁可能是氨水D. 若甲为NaOH,则丁可能是SO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com