
【题目】已知某条件下,合成氨反应的数据如下:
N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
起始浓度/mol·L-1 1.0 3.0 0.2
2s末浓度/mol·L-1 0.6 1.8 1.0
4s末浓度/mol·L-1 0.4 1.2 1.4
当用氨气浓度的增加来表示该反应的速率时,下列说法中错误的是 ( )
A. 2s末氨气的反应速率=0.4mol·(L·s)-1
B. 前2s时间内氨气的平均反应速率=0.4mol·(L·s)-1
C. 前4s时间内氨气的平均反应速率=0.3mol·(L·s)-1
D. 2~4s时间内氨气的平均反应速率=0.2mol·(L·s)-1
科目:高中化学 来源: 题型:
【题目】半导体工业会产生含氢氟酸的废水。回答下列问题:
(1)为了测定某含氢氟酸的废水中HF浓度,量取25.00mL废水,滴入2~3滴酚酞试液,用0.0100molL-1NaOH标准溶液滴定,用去27.00mL。滴定终点的判断方法是____________;废水中的c(HF)=__________________molL-1 (精确到0.0001)。
(2)用石灰乳处理含氢氟酸的废水时,会得到含氟底泥(主要含CaF2、CaCO3、CaSO4)。含氟底泥可用于制取氟化钙,其生产流程如下:
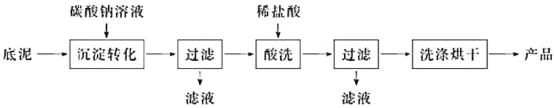
已知:氟化钙难溶于水,微溶于无机酸。
①“沉淀转化”的目的是将CaSO4转化为CaCO3。从平衡移动的角度分析,沉淀能够转化的原理是____________________________。
②最终得到的产品质量比底泥中CaF2的质量少,其原因是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理对于消除环境污染有重要意义。回答下列问题:
(1)NO2和N2O4以物质的量之比为1:1与O2和H2O恰好完全反应的化学方程式为_____。
(2)已知:2N2O5(g)![]() 2N2O4(g)+O2(g) H=-4.4kJ/mol
2N2O4(g)+O2(g) H=-4.4kJ/mol
N2O5(g)![]() 2NO2(g)+
2NO2(g)+![]() O2(g) H =+53.1 kJ/mol
O2(g) H =+53.1 kJ/mol
则反应2NO2(g)![]() N2O4(g)的H=___kJ/mol。
N2O4(g)的H=___kJ/mol。
(3)利用现代手持技术传感器可以探究压强对2NO2(g)![]() N2O4(g)化学平衡移动的影响。在恒定温度和标准压强(100kPa)条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、t2时刻迅速移动活塞后并保持活塞位置不变(不考虑温度的变化)。测定针筒内气体压强变化如图所示:
N2O4(g)化学平衡移动的影响。在恒定温度和标准压强(100kPa)条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、t2时刻迅速移动活塞后并保持活塞位置不变(不考虑温度的变化)。测定针筒内气体压强变化如图所示:
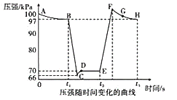
①B点时NO2的转化率为___;B点反应N2O4![]() 2NO2(g)的平衡常数Kp为____(Kp为以分压表示的平衡常数,计算结果保留1位小数)。
2NO2(g)的平衡常数Kp为____(Kp为以分压表示的平衡常数,计算结果保留1位小数)。
②B、E两点对应的正反应速率大小为νB___νE(请填“>”“<”或“=”)。
③E、F、G、H四点时对应气体的平均相对分子质量最大的点为___。
(4)反应物NO2可由2NO(g)+O2(g)![]() 2NO2生成,对该反应科学家提出如下反应历程:
2NO2生成,对该反应科学家提出如下反应历程:
第一步NO+NO![]() N2O2 快速平衡
N2O2 快速平衡
第二步N2O2+O2→2NO2 慢反应
下列说法正确的是_____(填标号)。
A.若第一步放热,温度升高,总反应速率可能减小
B.N2O2为该反应的催化剂
C.第二步反应的活化能比第一步反应的活化能大
D.第二步中N2O2与O2的碰撞100%有效
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.2 mol·L-1NaOH溶液480 mL和0.5 mol·L-1硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是________(填序号),配制上述溶液还需用到的玻璃仪器是________(填仪器名称)。
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]() E.
E. ![]()
(2)下列有关容量瓶使用方法的操作中,错误的是____。
A.使用容量瓶之前应检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.定容时,将蒸馏水小心倒入容量瓶中直至与刻度线齐平
D.配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中定容
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复上下颠倒,摇匀
(3)在配制NaOH溶液时:
①根据计算用托盘天平称取NaOH的质量为________g;
②若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度________(填“>”“<”或“=”)0.2 mol·L-1;
③若NaOH固体溶解后立即移入容量瓶→洗烧杯→洗涤液移入容量瓶→定容,则所得溶液浓度________(填“>”“<”或“=”)0.2 mol·L-1。
(4)在配制硫酸溶液时:
①所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为________(计算结果保留一位小数)mL;
②如果实验室有15 mL、20 mL、50 mL量筒,应选用______mL量筒最好;
③配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A 是石油裂解气的主要产物之一,其产量常用于衡量一个国家石油化工发展水平的标志。下列是有机物 A~G 之间的转化关系:
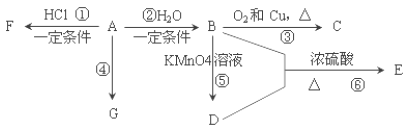
请回答下列问题:
(1)A 的官能团的名称是___________; C 的结构简式是________;
(2)E 是一种具有香味的液体, 由 B+D→E 的反应方程式为___________, 该反应类型是______________;
(3)G 是一种高分子化合物,其结构简式是______________;
(4)比赛中,当运动员肌肉挫伤或扭伤时,随队医生即对准受伤部位喷射物质 F(沸点 12.27°C)进行应急处理.写出由A 制 F 的化学反应方程式______________。
(5)E 的同分异构体能与 NaHCO3溶液反应,写出该同分异构体的结构简式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科研人员设计的CO2资源化利用的装置如图所示(电解质溶液为稀H2SO4),下列说法错误的是
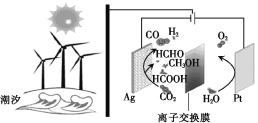
A.该离子交换膜为质子交换膜
B.Ag极上的电势比Pt极上的高
C.电路中每流过4 mol电子,阳极区质量减少36 g
D.太阳能、风能及潮汐能均是可再生能源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合理处理燃气中的H2S,不仅可资源化利用H2S,还可减少对大气的污染。回答下列问题:
(1)反应2H2S(g)=2H2(g)+S2(g) ΔH=+171.59 kJ·mol-1,该反应可在____(填“低温”“高温”或“任何温度”)下自发进行。
(2)利用H2S代替H2O通过热化学循环可高效制取H2,原理如图a所示:
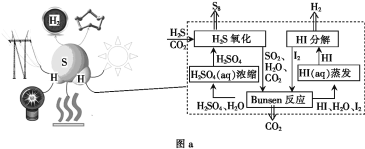
①“Bunsen反应”的离子方程式为________。
②已知键能E(I—I)=152.7 kJ·mol-1,E(H—H)=436.0 kJ·mol-1,E(H—I)=298.7 kJ·mol-1,HI气体分解为碘蒸气和氢气的热化学方程式为________。
③上述循环过程总反应方程式为________。
(3)Ahmed Daham Wiheeb等介绍的一种燃料电池的装置如图b所示:
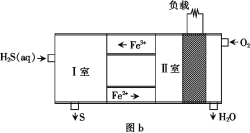
通入O2的电极为________(填“正极”或“负极”),每消耗3.36 L(标准状况下)O2,理论上消耗H2S的质量为____。
(4)为探究H2S直接热解[H2S(g) ![]() H2(g)+
H2(g)+![]() S2(g)],在一密闭容器中充入1 mol H2S与4 mol N2(N2不参与反应),维持总压在101 kPa下进行实验,图c是不同温度下反应时间与H2S的转化率的关系,图d是平衡时气体组成与温度的关系。
S2(g)],在一密闭容器中充入1 mol H2S与4 mol N2(N2不参与反应),维持总压在101 kPa下进行实验,图c是不同温度下反应时间与H2S的转化率的关系,图d是平衡时气体组成与温度的关系。
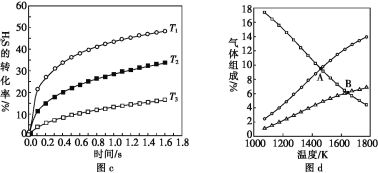
①图c中温度由高到低的顺序是________。
②图d中A点H2S的平衡转化率为______,B点时反应的平衡常数Kp=____(已知![]() ≈10)。
≈10)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题。
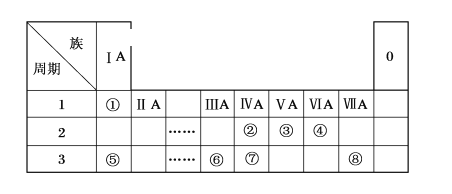
(1)④、⑤、⑥的原子半径由大到小的顺序是_____。(用元素符号表示)
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是____。
(3)③、④、⑥元素可形成含10个电子的微粒,其中A和B为分子,C和E为阳离子,D为阴离子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀。用电子式表示下列4种微粒:A_____、B____、C_____、D____。并写出A、B、E三种微粒反应的离子方程式________。
(4)由④⑤⑧三种元素组成的某种盐是家用消毒液的主要成分,将该盐溶液滴入KI淀粉溶液中溶液变为蓝色,则反应的离子方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列溶液中,能大量共存的离子组是( )
A.能使pH试纸显蓝色的溶液中:K+、Ba2+、Cl-、Br-
B.常温下pH=1的溶液中:Fe2+、Mg2+、NO![]() 、Cl-
、Cl-
C.含有大量Fe3+的溶液中:SCN-、I-、K+、Br-
D.能使石蕊试液显红色的溶液中:K+、![]() 、S2-、
、S2-、![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com