
����Ŀ��ʵ������Ҫ0��2 mol��L��1NaOH��Һ480 mL��0��5 mol��L��1������Һ500 mL��������������Һ����������ش��������⣺
(1)��ͼ��ʾ��������������Һ�϶�����Ҫ����________(�����)������������Һ�����õ��IJ���������________(����������)��
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]() E.
E. ![]()
(2)�����й�����ƿʹ�÷����IJ����У��������____��
A��ʹ������ƿ֮ǰӦ������Ƿ�©ˮ
B������ƿ������ˮϴ�������ô�����Һ��ϴ
C������ʱ��������ˮС�ĵ�������ƿ��ֱ����̶�����ƽ
D��������Һʱ�����������Һ�壬����Ͳ��ȡ������ֱ�ӵ�������ƿ�ж���
E���Ǻ�ƿ������ʳָ��סƿ������һֻ����סƿ�ף�������ƿ�������µߵ���ҡ��
(3)������NaOH��Һʱ��
�ٸ��ݼ�����������ƽ��ȡNaOH������Ϊ________g��
����NaOH��Һ��ת��������ƿʱ����������������������ҺŨ��________(����>����<����������)0.2 mol��L��1��
����NaOH�����ܽ��������������ƿ��ϴ�ձ���ϴ��Һ��������ƿ�����ݣ���������ҺŨ��________(����>����<����������)0.2 mol��L��1��
(4)������������Һʱ��
��������������Ϊ98%���ܶ�Ϊ1.84 g��cm��3��Ũ��������Ϊ________(����������һλС��)mL��
�����ʵ������15 mL��20 mL��50 mL��Ͳ��Ӧѡ��______mL��Ͳ��ã�
�����ƹ������������ձ��н�Ũ�������ϡ�ͣ�ϡ��ʱ����������_______________��
���𰸡�AC �ձ��������� BCD 4.0 < > 13.6 15 ��Ũ���������ڻ�������ˮ�У����ò��������Ͻ���
��������
��1������һ�����ʵ���Ũ����Һһ�㲽�裺���㡢��������ȡ���ܽ��ϡ�͡���ȴ����Һ��ϴ�ӡ����ݡ�ҡ�ȵȣ��ݴ�ѡ����Ҫ��������
��2������ƿ����ϡ��Ũ��Һ�����������ܽ���塢������Һ�ȣ�
��3������m=cVM������Ҫ���ʵ������������������������ʵ�������Һ�����Ӱ�죬����c=![]() ���������������
���������������
��4������c=![]() ����Ũ�����Ũ�ȣ��ٸ���Ũ����ϡ��ǰ�����ʵ����ʵ���������㣻Ũ����ϡ�Ͳ����������ȣ�Ӧ��Ũ����ע��ˮ�У�ͬʱ�ò��������Ͻ��衣
����Ũ�����Ũ�ȣ��ٸ���Ũ����ϡ��ǰ�����ʵ����ʵ���������㣻Ũ����ϡ�Ͳ����������ȣ�Ӧ��Ũ����ע��ˮ�У�ͬʱ�ò��������Ͻ��衣
��1������һ�����ʵ���Ũ����Һһ�㲽�裺���㡢��������ȡ���ܽ��ϡ�͡���ȴ����Һ��ϴ�ӡ����ݡ�ҡ�ȵȣ��õ���������������ƽ����Ͳ�����ձ�����������500mL����ƿ����ͷ�ιܣ������ò�����������Բ����ƿ����Һ©������ȱ�ٵIJ����������ձ������������ʴ�Ϊ��AC���ձ�����������
��2��A�����л���������ʹ��ǰҪ����Ƿ�©ˮ����A��ȷ��
B������ƿ������ˮϴ�������ô���Һ��ϴ���ᵼ��������ҺŨ��ƫ��B����
C������ʱ��Ӧֱ�Ӽ�����ˮ����̶���1-2cm����ý�ͷ�ι���εμӣ���C����
D������ƿ��������ϡ��Ũ��Һ����D����
E��ҡ��ʱʳָ��סƿ��������һֻ�ֵ���ָ��סƿ�ף�������ƿ��ת��������ҡ�ȣ���E��ȷ���ʴ�Ϊ��BCD��
��3����Ҫ����0.2mol/L NaOH��Һ480mL��Ӧѡ��500mL����ƿ����Ҫ������������=0.2mol/L��0.5L��40g/mol=4.0g���ʴ�Ϊ��4.0��
��ijС�齫NaOH��Һ��ת��������ƿʱ�����������������³�ȡ���ʵ�����ƫС�����ʵ����ʵ���ƫС����������ҺŨ��ƫС���ʴ�Ϊ������
���������ƹ����ܽ���Һ�¶����ߣ���NaOH�����ܽ��������������ƿ����Һ�����ȴ�������ڿ̶������£�������ҺŨ��ƫ�ʴ�Ϊ������
��4������������Ϊ98%���ܶ�Ϊ1.84gcm-3��Ũ�������ʵ���Ũ��Ϊ![]() mol/L=18.4mol/L������ҪŨ�������ΪV����������Һϡ���������ʵ����ʵ����������ã�18.4mol/L��V=0.5molL-1��500mL�����V=13.6mL���ʴ�Ϊ��13.6��
mol/L=18.4mol/L������ҪŨ�������ΪV����������Һϡ���������ʵ����ʵ����������ã�18.4mol/L��V=0.5molL-1��500mL�����V=13.6mL���ʴ�Ϊ��13.6��
�ڸ�����Ͳ��ѡ�����������ԭ������Ӧѡ��15mL��Ͳ��ã��ʴ�Ϊ��15��
��Ũ����ϡ�ͣ���Ũ���������ڣ�������������ע��ˮ�У��ұӱ߽��裬�ʴ�Ϊ����Ũ���������ڻ�������ˮ�У����ò��������Ͻ��衣



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����л��������˵���������
A. ���顢�����Ҵ������������ʹ���Ը��������Һ��ɫ
B. C4H8Cl2��9��ͬ���칹��(���������칹)
C. ˫�ǡ����ǡ���֬�͵����ʶ��ܷ���ˮ�ⷴӦ
D. ʯ�;��ѻ����ѽ���Եõ���ϩ����ϩ���������Ҫ��������ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�ַ��ϵ���Ҫ�ɷ��������Ͻ𣬻�����ͭ���ơ�þ�����������ɸ÷����Ʊ��Ĵ��Ƚϸߵ����������������������£���֪������Ksp[Ni(OH)2]=1.0��10-15��������˵��������ǣ� ��
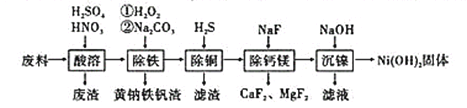
A. ������������������
B. ������п�����߳���Ч��
C. ��ͭ�����У���Һ������ǿ
D. ��������������Ϊ�˽���������ȫ����Ҫ����pH��9
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.5 LijŨ�ȵ�NaCl��Һ�к���0.5 mol NaCl�����жԸ���Һ��˵���У�����ȷ����
A. ����Һ���ʵ����ʵ���Ũ��Ϊ1 mol��L-1
B. ����Һ�к���58.5 g NaCl
C. ����100 mL����Һ����5.85 g NaCl
D. ��ȡ100 mL����Һ�����ձ��У��ձ��е�NaCl���ʵ���Ϊ0.1 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�������ʹ�û�ʵ�������ȷ����
A.��ϡ����ϴ��H2��ԭCuO���Թ��ڱڵ�ͭ
B.����ʱ,����������Һ�������ܳ�����������![]()
C.���뱽��ȡ��ˮ��ķֲ�Һ��,�ӷ�Һ©���¿��ȷų�ˮ��,�ٷų��л���
D.��KMnO4��Һ�ⶨNa2C2O4��Ũ��ʱ,KMnO4��Һʢ���ڼ�ʽ�ζ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����agij���������������г��ȼ���ٽ�����������ͨ��������Na2O2��ַ�Ӧ����������Ϊbg����a<b��������ʿ����ǣ� ��
A. H2B. COC. ����(CH3COOH)D. ����(CH4)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ij�����£��ϳɰ���Ӧ���������£�
���������������� N2(g)��3H2(g)![]() 2NH3(g)
2NH3(g)
��ʼŨ��/mol��L��1���� 1.0���� 3.0�������� 0.2
2sĩŨ��/mol��L��1������ 0.6���� 1.8��������1.0
4sĩŨ��/mol��L��1������ 0.4���� 1.2��������1.4
���ð���Ũ�ȵ���������ʾ�÷�Ӧ������ʱ������˵���д������ (����)
A. 2sĩ�����ķ�Ӧ���ʣ�0.4mol��(L��s)��1
B. ǰ2sʱ���ڰ�����ƽ����Ӧ���ʣ�0.4mol��(L��s)��1
C. ǰ4sʱ���ڰ�����ƽ����Ӧ���ʣ�0.3mol��(L��s)��1
D. 2��4sʱ���ڰ�����ƽ����Ӧ���ʣ�0.2mol��(L��s)��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Ƴ���Ư����ɱ���������������������Ʊ��治���������տ�����CO�������ʡ�
��1��ij����С����̽��ij����������Ʒ�Ƿ��Ѿ����ʣ�ȡ������Ʒ���ܽ⣬����__________��Һ��������а�ɫ������֤��Na2O2�Ѿ����ʡ�
��2���ÿ���С��Ϊ�˴��Բⶨ�������ƵĴ��ȣ����dz�ȡa g��Ʒ�����������ͼװ�����ⶨ�������Ƶ�����������

��A�з�����Ӧ���ӷ���ʽΪ_____________________��
�����������Ӻ��Ժ�����еĵ�һ��������_____________________��
��Bװ�ó����������Ƿ���Ҫ����_________________������ǡ���
��д��װ��C�з��������з�Ӧ�Ļ�ѧ����ʽ_____________��______________��
��D��NaOH��Һ������_______________________��
��ʵ�����ʱ����ȡʵ����������������ʱ������������_______________��
a.ֱ�Ӷ�ȡ���������������ȴ������
b.�����ƶ���Ͳ��ʹ��E��F��Һ��߶���ͬ
c.�����밼Һ�����͵���ƽ��ȡ��Ͳ��ˮ�����
��������Ͳ��ˮ�����������ɱ�״�������������ΪV mL������Ʒ�й������Ƶ���������Ϊ__________________��
��ʵ����ɺ�E��F֮�䵼���ڲ���ˮ�������ʹ�������__________�����ƫ����ƫС����Ӱ�족��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijУ��ѧ�о���ѧϰС����������˽�������ݣ�
�Ҷ��ᣨHOOC��COOH���ɼ�дΪH2C2O4���׳Ʋ��ᣬ������ˮ�����ڶ�Ԫ��ǿ�ᣨΪ������ʣ���������ǿ��̼�ᣬ���۵�Ϊ101.5�棬��157��������Ϊ̽������IJ��ֻ�ѧ���ʣ�����������ʵ�飺
��1����ʢ��1mL����NaHCO3��Һ���Թ��м��������Ҷ�����Һ���۲쵽����ɫ���ݲ������÷�Ӧ�����ӷ���ʽΪ________��
��2����ʢ���Ҷ��ᱥ����Һ���Թ��е��뼸�������ữ��KMnO4��Һ������������Һ���Ϻ�ɫ��ȥ����˵���Ҷ������______��������������������ԭ������������������������ƽ�÷�Ӧ�����ӷ���ʽ��_____MnO4-+____H2C2O4+___H+=___Mn2++____CO2��+_____H2O
��3����һ�������Ҷ�������Թ��У�����ͼ��ʾװ�ý���ʵ�飨�г�װ��δ�������

ʵ�鷢�֣�װ��C��G�г���ʯ��ˮ����ǣ�B��CuSO4��ĩ������F��CuO��ĩ��졣�ݴ˻ش�
������װ���У�D��������_________��
���Ҷ���ֽ�Ļ�ѧ����ʽΪ ________��
��4����С��ͬѧ��2.52g���ᾧ�壨H2C2O42H2O�����뵽100mL 0.2mol/L��NaOH��Һ�г�ַ�Ӧ����÷�Ӧ����Һ�����ԣ���ԭ����_______�������ּ�����������Һ�и����ӵ�Ũ���ɴ�С��˳��Ϊ��_______�������ӷ��ű�ʾ����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com