
| A、向水中加入少量NH4Cl,由水电离出的c(H+)>1×10-7mol/L |
| B、升高温度,水的电离程度增大,c(H+)增大,pH<7,所以溶液显酸性 |
| C、向水中加入氨水,平衡逆向移动,水的电离受到抑制,所以c(OH-)降低 |
| D、向水中加入少量硫酸,c(H+)增大,所以由水电离出的c(H+)>1×10-7mol/L |


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
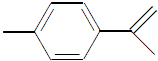 ,下列关于这种物质的说法中正确的是( )
,下列关于这种物质的说法中正确的是( )| A、分子式为C9H12 |
| B、易发生取代反应,难发生加成反应 |
| C、可使溴的四氯化碳溶液褪色 |
| D、该物质易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=9 |
| B、c(OH-)≈10-5 mol?L-1 |
| C、pH≈7 |
| D、c(OH-)<10-7 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=l或pH=13 |
| B、阴离子肯定有I-,不能确定有无HCO3 |
| C、阴离子肯定没有Fe3+,不能确定有无Na+ |
| D、溶质有3种可能:①HI②HI和NaI③NaI和NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、图①装置的烧杯中先出现白色沉淀后溶解 |
| B、图②装置可验证氧化性:ClO->Cl2>Fe3+ |
| C、图③装置可用于实验室制备乙烯 |
| D、图④装置可证明Na2CO3比NaHCO3更稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4L CCl4含有NA个分子 |
| B、常温常压下46g NO2和N2O4混合气体含有3NA个原子 |
| C、0.1mol AlCl3完全转化为氢氧化铝胶体,生成0.lNA个胶体粒子 |
| D、0.1mol Cl2与足量NaOH溶液反应,转移电子数为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com