
【题目】某化学兴趣小组在学习了电解质的有关知识后,老师提出了一个“电解质水溶液导电能力的强弱的影响因素”的课题。让该小组来完成课题的研究,已知HCl在水中能完全电离。
(1)该小组同学首先用密度为1.049 g·cm-3的乙酸(CH3COOH)和质量分数为36.5%,密度为1.18 g·cm-3的浓盐酸分别配制1 mol/L CH3COOH溶液和1 mol/L HCl溶液各500 mL,则他们应该量取乙酸和浓盐酸的体积分别为_________和__________;
(2)某同学在配制500 mL 1 mol/L的CH3COOH溶液时,向容量瓶中转移溶液时操作如图所示,图中的错误有__________________________________________;
(3)他们首先用下图所示装置测1 mol/L的CH3COOH溶液和1 mol/L HCl溶液的导电能力,接通电源后发现与HCl溶液相连的灯泡较亮,有同学认为乙酸是弱电解质,你_______(填“同意”或“不同意”)他的观点,通过该现象你得到的结论是_______________________________________
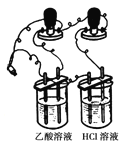
(4)他们又用上述装置测物质的量浓度相同的CuSO4溶液和NaOH溶液的导电能力,接通电源后发现与CuSO4溶液相连的灯泡较亮,有同学认为NaOH是弱电解质,你___________(填“同意”或“不同意”)他的观点,通过该现象你得到的结论是_______________________________________;
(5)通过上述探究实验,你能得到的结论是_______________________________________
【答案】28.6 mL 42.4 mL 未用玻璃棒引流 未采用500 mL容量瓶 同意 阴、阳离子带电荷数目相同时,单位体积内自由移动离子数目越大,电解质溶液的导电能力越强 不同意 当单位体积内自由移动离子数目相同时,阴、阳离子带电荷数目越多,电解质溶液的导电能力越强 电解质溶液的导电能力是由单位体积内自由移动离子数目和离子所带电荷数目共同决定
【解析】
(1)两种溶液的溶质的量相等,根据据V=![]() 进行计算,注意盐酸溶液中0.5×36.5不是溶液的质量。
进行计算,注意盐酸溶液中0.5×36.5不是溶液的质量。
(2)转移溶液应该用玻璃棒进行引流,配制500mL溶液应该选用500mL容量瓶;
(3)醋酸和盐酸电离出的阴阳离子所带电荷均相同;阴、阳离子带电荷数目相同时,单位体积内自由移动离子数目越大,电解质溶液的导电能力越强;
(4)电解质溶液导电能力与溶液中离子浓度及离子所带电荷有关;当单位体积内自由移动离子数目相同时,阴、阳离子带电荷数目越多,电解质溶液的导电能力越强,铜离子、硫酸根离子带有的电荷数大于钠离子、氢氧根离子带有的电荷数,因此用上述装置测物质的量浓度相同的CuSO4溶液和NaOH溶液的导电能力,接通电源后发现与CuSO4溶液相连的灯泡较亮,不能确定NaOH是弱电解质;
(5)根据(3)(4)探究实验的现象得出结论。
(1)两种溶液的溶质均为0.5L×1mol/L=0.5mol;根据V=![]() 可知,乙酸溶液的体积:V=
可知,乙酸溶液的体积:V=![]() =28.6mL;盐酸溶液的体积为:
=28.6mL;盐酸溶液的体积为:![]() =42.4mL;
=42.4mL;
(2)转移溶液应该用玻璃棒进行引流,配制500mL溶液应该选用500mL容量瓶;故答案是:未用玻璃棒引流;未采用500mL容量瓶;
(3)醋酸和盐酸电离出的阴阳离子所带电荷均相同;阴、阳离子带电荷数目相同时,单位体积内自由移动离子数目越大,电解质溶液的导电能力越强,因此用图示装置测1mol/L的CH3COOH溶液和1mol/LHCl溶液的导电能力,接通电源后发现与HCl溶液相连的灯泡较亮,可以得出乙酸是弱电解质的结论;
(4)硫酸铜和氢氧化钠电离出的离子数目相同,当单位体积内自由移动离子数目相同时,阴、阳离子带电荷数目越多,电解质溶液的导电能力越强,铜离子、硫酸根离子带有的电荷数大于钠离子、氢氧根离子带有的电荷数,因此用上述装置测物质的量浓度相同的CuSO4溶液和NaOH溶液的导电能力,接通电源后发现与CuSO4溶液相连的灯泡较亮,但不能确定NaOH是弱电解质;
(5)通过上述探究实验,得到的结论是电解质溶液的导电能力是由单位体积内自由移动离子数目和离子所带电荷数目共同决定。


科目:高中化学 来源: 题型:
【题目】在一固定容积为2 L的密闭容器中加入2 molA和3 molB,保持温度为30℃,在催化剂存在的条件下进行下列反应:2A(g)+3B(g) ![]() 3C(g),2分钟达到平衡,生成1.5 mol C,此时,平衡混合气中C的体积分数为ω1;若将温度升高到70℃后,其他条件均不变,当反应重新达到平衡时,C的物质的量为2.1 mol,体积分数为ω2,请回答下列问题,
3C(g),2分钟达到平衡,生成1.5 mol C,此时,平衡混合气中C的体积分数为ω1;若将温度升高到70℃后,其他条件均不变,当反应重新达到平衡时,C的物质的量为2.1 mol,体积分数为ω2,请回答下列问题,
(1)该反应在30℃时平衡常数K1=_________ ,焓变△H_______0(填“>”、“<”或“=”)。
(2)从反应开始到达到化学平衡状态v(A)____________mol/(L·min)
(3)该反应在70℃时平衡常数为K2,则 K1_______K2(填“>”、“=”或“<”)
(4)可以判断2A(g)+3B(g) ![]() 3C(g) 反应已经达到平衡(____)
3C(g) 反应已经达到平衡(____)
A.2v(B)=3v(A)
B.密闭容器中总压强不变
C. 密闭容器中混合气体的密度不变
D.混合气体的平均相对分子质量不再改变
E.n(A)∶n(B)∶n(C)=2∶3∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2 L的密闭容器中,有反应mA(g)+nB(g)![]() pC(g)+qD(g),经过5 min达到平衡,此时各物质的变化为A物质的量浓度减少amol·L-1,B的平均反应速率v(B)=a/15 mol·L-1·min-1,C物质的量浓度增加2a/3 mol·L-1,这时若增大系统压强,发现A与C的百分含量不变,则m∶n∶p∶q为( )
pC(g)+qD(g),经过5 min达到平衡,此时各物质的变化为A物质的量浓度减少amol·L-1,B的平均反应速率v(B)=a/15 mol·L-1·min-1,C物质的量浓度增加2a/3 mol·L-1,这时若增大系统压强,发现A与C的百分含量不变,则m∶n∶p∶q为( )
A.3∶1∶2∶2B.1∶3∶2∶2C.3∶1∶2∶1D.1∶1∶1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1799年,英国化学家汉弗莱·戴维发现了N2O气体。在食品行业中,N2O可用作发泡剂和密封剂。
(1)N2O是硝酸生产中氨催化氧化的副产物,NH3与O2在加热和催化剂的作用下生成N2O的化学方程式为_________。
(2)N2O在金粉表面发生热分解反应:2N2O(g) =2N2(g)+O2(g) △H。
已知:2NH3(g) + 3N2O(g) = 4N2(g) + 3 H2O(l) △H1
4NH3(g) + 3O2(g) = 2N2(g) + 6H2O(l) △H2
△H= _________(用含△H1、△H2的代数式表示)。
(3)N2O和CO是环境污染性气体,这两种气体会发生反应:N2O(g)+CO)(g)CO2(g)十N2(g),“Fe+”常用作该反应的催化剂。 其总反应分两步进行:
第一步为Fe+ +N2OFeO+ +N2;第二步为________(写化学方程式)。
第二步反应几乎不影响总反应达到平衡所用的时间,由此推知,第二步反应活化能_______ (填“大于”“小于”或“等于”)第一步反应活化能。
(4)在四个恒容密闭容器中充入相应量的气体(图甲),发生反应2N2O(g)2N2(g)+O2(g) △H,容器Ⅰ、Ⅱ、Ⅲ中N2O的平衡转化率如图乙所示:
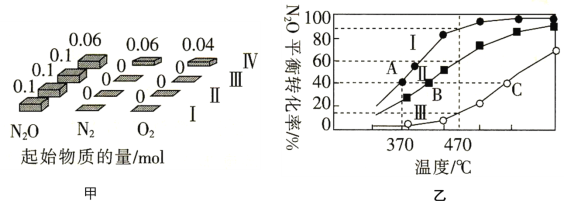
①该反应的△H________(填“>”或“<”)0。
②容器Ⅱ的体积为5L,在470℃下进行反应,30s后达到平衡,0~30s内容器Ⅱ中O2的反应速率为_________mol.L-1.min-1 ;容器Ⅳ的体积为1L,容器Ⅳ中的物质也在470℃下进行反应,起始反应速率:![]() 正(N2O)_______
正(N2O)_______![]() 逆(N2O)。(填“>”“<”或“=”)
逆(N2O)。(填“>”“<”或“=”)
③图中A、B、C三点处容器内密度最大的点是_________(填“A”“B”或“C”)。
④已知容器Ⅰ的体积为10L,370℃时,该反应的平衡常数k=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近科学家获得了一种稳定性好、抗氧化能力强的活性化合物A;其结构如下:
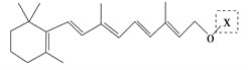
为了研究X的结构,将化合物A在一定条件下水解只得到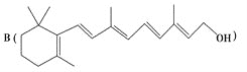 和C。经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生。
和C。经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生。
请回答下列问题:
(1)化合物B能发生下列哪些类型的反应________。
A.取代反应 B.加成反应
C.缩聚反应 D.氧化反应
(2)写出化合物C所有可能的结构简式______________________________。
(3)C可通过下图所示途径合成,并制取冬青油和阿司匹林。

(ⅰ)写出有机物的结构简式:D:______________,C:________________,E:______________。
(ⅱ)写出变化过程中①、⑥的化学方程式(注明反应条件)
反应①__________________________________;反应⑥_____________________________。
(ⅲ)变化过程中的②属于____________反应,⑦属于________反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上苯乙烯是合成树脂、离子交换树脂及合成橡胶等的重要单体,如图是苯乙烯的结构简式:![]() ,下列关于该有机物的说法不正确的是( )
,下列关于该有机物的说法不正确的是( )
A. 苯乙烯的分子式为C8H8
B. 苯乙烯通过加聚反应可制备高分子化合物
C. 苯乙烯与溴的四氯化碳溶液反应:![]()
D. 苯乙烯能发生加成反应,但不能发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某澄清透明溶液中只可能含有:①Al3+ ②Mg2+③Fe3+④Cu2+⑤H+⑥CO32-⑦NO3-中的几种,向该溶液中逐滴加人NaOH溶液至过量,生成沉淀的质量与NaOH的物质的量的关系如图所示。则该溶液中一定含有的离子是
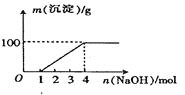
A.②⑤⑦B.②③⑤⑦C.③⑤⑦D.④⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯仿(CHC13)是无色透明液体,不溶于水和浓硫酸,溶于醇,沸点为61.2℃,工业品氯仿中常含有少量乙醇。某校同学设计实验制备少量氯仿。
(1)甲组同学设计下列装置用干燥纯净的氯气制备实验原料漂白粉[已知:3Ca(ClO)2 ![]() Ca(ClO3)2+2CaCl2 △H>0]。
Ca(ClO3)2+2CaCl2 △H>0]。
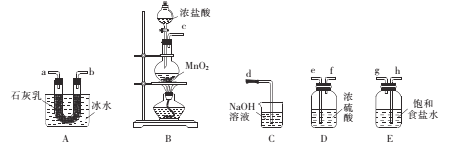
①各仪器接口连接顺序为____(气流白左至右,用小写字母表示)。
②装置B中发生反应的离子方程式为 ___。
③装置A用冰水冷却的目的是____。
(2)乙组同学用甲组制得的漂白粉与乙醇溶液反应制备氯仿的实验装置如图。
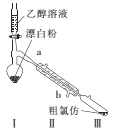
①装置I需控制温度约为70℃,适宜的加热方式是 ___,温度不宜过高,其目的是____。
②装置Ⅱ的名称是____。
③一定条件下,装置I中漂白粉先与乙醇溶液反应生成Cl2和Ca(OH)2,然后Cl2与CH3CH2OH反应生成CCl3CHO,CCl3CHO再与Ca(OH)2反应生成CHC13和一种盐,CCl3CHO与Ca(OH)2反应的化学方程式为 _________。
(3)丙组同学用下列方法对乙组制得的粗产品进行提纯。已知浓硫酸能与乙醇混溶。
步骤I.向粗产品中加入适量浓硫酸,搅拌至呈淡咖啡色,分液得有机层;
步骤Ⅱ.用15%的Na2CO3溶液洗涤多次,分液得有机层;
步骤Ⅲ.向有机层中加入少量无水CaCl2。
步骤I中用浓硫酸洗涤的目的是____;步骤Ⅱ中证明已洗涤干净的依据是____;步骤Ⅲ中加入少量无水CaCl2的目的是 ___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学固氮可以在常温常压下实现氮气的还原合成氨,某课题组提出一种全新的电化学固氮机理——表面氢化机理示意图如下,则有关说法错误的是( )
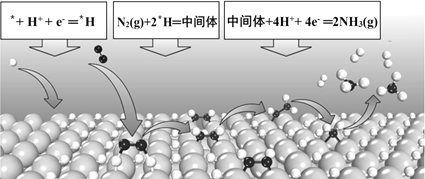
A.在表面氢化机理中,第一步是H+的还原反应
B.在表面*H原子与催化剂的协同作用下,N2与表面*H原子反应生成*N2H4中间体
C.电化学固氮法较传统工业合成氨将空气中的游离氮固定,具有能耗小、环境友好的优点
D.若竞争反应(析氢反应)的势垒显著低于固氮反应,则析氢反应的速率要远远高于固氮反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com