
【题目】下面有关离子晶体的叙述中,不正确的是( )
A.1mol氯化钠中有NA个NaCl分子
B.氯化钠晶体中,每个Na+周围紧邻6个Cl-
C.氯化铯晶体中,每个Cs+周围紧邻8个Cl-
D.平均每个NaCl晶胞中有4个Na+、4个Cl-
科目:高中化学 来源: 题型:
【题目】硼氢化钠(NaBH4)在工业生产中应用广泛。它在催化剂作用下与水反应获取氢气的微观过程如图所示。下列说法正确的是( )
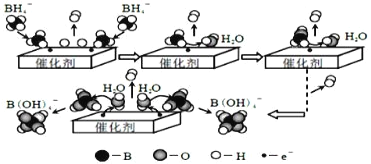
A.水在此过程中作还原剂
B.若将NaBH4中的H用D代替,反应后生成的气体中含有H2、HD和D2
C.催化剂可以加快反应速率,其用量多少不影响反应速率
D.NaBH4与水反应的离子方程式为:BH4-+4H2O=B(OH)4-+4H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图是某条件下N2与H2反应过程中能量变化的曲线图。下列叙述正确的是( )
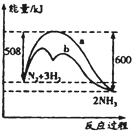
A. 该反应的热化学方程式为:N2+3H2![]() 2NH3 △H=-92kJ·mol-1
2NH3 △H=-92kJ·mol-1
B. 正反应的活化能大于逆反应的活化能
C. b曲线是加入催化剂时的能量变化曲线
D. 使用催化剂后反应的焓变减小,N2转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物在人类生活和生产中必不可少,下列对有机化合物的叙述不正确的是( )
A.甲烷是天然气的主要成分,是最简单的烃,其含碳量为75%
B.乙醇的分子式为![]() ,常温下是一种无色液体,密度比水小
,常温下是一种无色液体,密度比水小
C.乙酸的结构简式是![]() ,易溶于水,酸性比
,易溶于水,酸性比![]() 的强
的强
D.乙烯是重要的化工原料,能使溴水和酸性高锰酸钾溶液褪色,其原理均是乙烯具有漂白作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物a和苯通过反应合成b的过程可表示为下图(无机小分子产物略去)。则下列说法错误的是( )

A.该反应是取代反应
B.若R为—CH3时,b中所有碳原子共面
C.若R为—C4H9时,则b中苯环上的一氯代物可能的结构共有12种
D.若R为—C4H5时,1mol b最多可以与4molH2加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)。
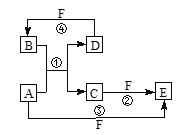
(1)若A为短周期元素的金属单质,D为短周期元素的非金属单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,F的浓溶液与A、D反应都有红棕色气体生成,则A的原子结构示意图为__________,反应④的化学方程式为_____________。
(2)若A是常见的金属单质,D、F是气体单质,反应①在水溶液中进行,则反应②(在水溶液中进行)的离子方程式是________________。已知1g D与F反应生成B(气态)时放出92.3kJ热量,写出该反应的热化学方程式:_______________________。
(3)若A、D、F都是短周期非金属元素的单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式为____________,B固体属于____________晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某可逆反应mA(g)+nB(g)![]() pC(g)在密闭容器中进行,下图表示在不同反应时间t时,温度T和压强P与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是
pC(g)在密闭容器中进行,下图表示在不同反应时间t时,温度T和压强P与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是
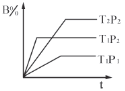
A.T1<T2 P1>P2 m+n>p放热反应B.T1>T2 P1<P2 m+n>p吸热反应
C.T1<T2 P1>P2 m+n<p放热反应D.T1>T2 P1<P2 m+n<p吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
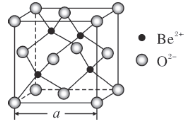
【题目】祖母绿被称为绿宝石之王,是四大名贵宝石之一,其主要成分为Be3Al2Si6O18,因含有微量的Cr、Ni、Fe元素而呈现各种颜色。回答下列问题:
(1)祖母绿宝石属于晶体,鉴别晶体最可靠的科学方法是_____________。
(2)基态Cr原子的价层电子排布式为_________;基态Si原子电子占据最高能级的电子云轮廓图为_________。
(3)六羰基铬[Cr(CO)6]用于制高纯度铬粉,它的沸点为220℃。Cr(CO)6的晶体类型是_______,1 mol Cr(CO)6中含σ键的数目为_________;
(4)BeCl2分子的空间构型是_________,写出该分子的一种等电子体的分子式_________。它的二聚体Be2Cl4结构如图所示Cl-Be![]() Be-Cl,,其中Be原子的杂化方式是_________。
Be-Cl,,其中Be原子的杂化方式是_________。
(5)BeO的立方晶胞如图所示,在该晶胞中与一个O2-距离最近且相等的O2-有________个。若该晶体的密度为d g·cm-3,设阿伏加德罗常数的值为NA,则晶胞边长a=________nm。(列出计算表达式)
(6)多数配离子显示颜色与d轨道的分裂能有关。分裂能是指配离子的中心原子(离子)的一个电子从较低能量的d轨道跃迁到较高能量的d轨道所需的能量(用△表示),它与中心离子的结构、电荷、配体有关。试判断分裂能△[Fe(H2O)6]3+________ △[Fe(H2O)6]2+(填“>”、“=”或“<”),理由是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,把试管放入盛有25 ℃饱和澄清石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入10 mL盐酸于试管中,试回答下列问题:
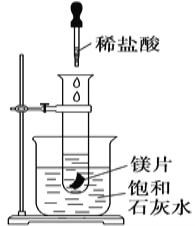
(1)实验中观察到的现象是________________________________ 。
(2)产生上述现象的原因是____________________________。
(3)写出有关反应的离子方程式:_________________________________; 反应中转移了0. 04mol电子时;标准状况下产生多少________mL的H2。
(4)由实验推知,镁片溶液和盐酸的总能量________(填“大于”、“小于”或“等于”) MgCl2和H2的总能量;此反应为________ (填放热反应或者吸热反应)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com