

| A.表示1mol H2 (g)完全燃烧生成水蒸气吸收241.8 kJ热量 |
| B.表示的热化学方程式为:H2(g)+ 1/2 O2(g) → H2O(g) +241.8 kJ |
| C.表示2 mol H2(g)所具有的能量一定比2 mol气态水所具有的能量多483.6 kJ |
| D.H2O(g)的能量低于H2(g)和O2(g)的能量之和 |
科目:高中化学 来源:不详 题型:单选题
A.已知:H2(g)+ O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1,则H2的燃烧热为-241.8 kJ·mol-1 O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1,则H2的燃烧热为-241.8 kJ·mol-1 |
| B.已知:S(g)+O2(g)=SO2(g) ΔH1=-Q1;S(s)+O2(g)=SO2(g) ΔH2=-Q2(Q1、Q2均正值),则Q1<Q2 |
C.已知: H2SO4(浓)+NaOH(aq)= H2SO4(浓)+NaOH(aq)= Na2SO4(aq)+H2O(l) ΔH1;CH3COOH(aq)+NH3·H2O(aq)=CH3COONH4(aq)+H2O(l) ΔH2,则有|ΔH1|<|ΔH2| Na2SO4(aq)+H2O(l) ΔH1;CH3COOH(aq)+NH3·H2O(aq)=CH3COONH4(aq)+H2O(l) ΔH2,则有|ΔH1|<|ΔH2| |
D.已知:Fe2O3(s)+3C(石墨,s)=2Fe(s)+3CO(g) ΔH=+489.0 kJ·mol-1;CO(g)+ O2(g)=CO2(g)ΔH=-283.0 kJ·mol-1;C(石墨,s)+O2(g)=CO2(g)ΔH=-393.5 kJ·mol-1,则4Fe(s)+3O2(g)=2Fe2O3(s) ΔH=-1641 kJ·mol-1 O2(g)=CO2(g)ΔH=-283.0 kJ·mol-1;C(石墨,s)+O2(g)=CO2(g)ΔH=-393.5 kJ·mol-1,则4Fe(s)+3O2(g)=2Fe2O3(s) ΔH=-1641 kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.a<c<0 | B.b>d>0 |
| C.2a=b<0 | D.2c=d>0 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.由单质A转化为单质B,ΔH=+119kJ/mol,可知单质A比单质B稳定 |
| B.灼热的碳与CO2反应既是氧化还原反应,又是生成物总能量高于反应物总能量的反应 |
| C.决定化学反应速率的根本因素是参加反应的各物质的结构和性质 |
| D.对于一个可逆反应(ΔH<0)达到平衡后,升高温度可以增加活化分子的百分数,提高有效碰撞的次数,使V正增大的倍数大于V逆增大的倍数,从而使化学反应平衡逆向移动 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2NH3(g) △H=— 92.4kJ?mo1—1,下列结论正确的是
2NH3(g) △H=— 92.4kJ?mo1—1,下列结论正确的是| A.在密闭容器中加入1mol N2和3mol H2充分反应放热92.4kJ |
B.N2(g)+3H2(g) 2NH3(l)△H=— QkJ?mo1—1,则Q>92.4 2NH3(l)△H=— QkJ?mo1—1,则Q>92.4 |
| C.增大压强,平衡向右移动,平衡常数增大 |
| D.若一定条件下反应达到平衡,N2的转化率为20%,则H2的转化率一定为60% |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.如图表明催化剂可以改变反应的热效应 |
| B.如图表示某反应能量的变化与生成物状态无关 |
| C.如图表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
| D.如图表明化学反应不仅遵循质量守恒定律,也遵循能量守恒 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.反应过程中能量关系如上图表示,则该反应为放热反应 |
| B.若将其设计为原电池,当有32.5 g锌溶解时,正极放出气体一定为11.2 L |
| C.化学反应的焓变与反应方程式的计量系数有关 |
| D.若将该反应设计成原电池,锌为负极 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
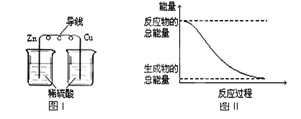
| A.化学反应中能量变化的主要原因是化学键的断裂与生成 |
| B.铝热反应中, 反应物的总能量比生成物的总能量低 |
| C.图I所示的装置能将化学能转变为电能 |
| D.图II所示的反应为吸热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com