
【题目】已知A可以作水果的催熟剂,D是食醋的主要成分.相关的转化关系如下: 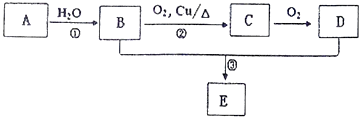
请回答下列问题:
(1)A的结构简式为 , 反应①的反应类型是 .
(2)C的名称是 .
(3)反应③的化学方程式为 , 该反应类型是 .
【答案】
(1)CH2=CH2;加成反应
(2)乙醛
(3)CH3CH2OH+CH3COOH ![]() CH3COOCH2CH3+H2O;取代反应或酯化反应
CH3COOCH2CH3+H2O;取代反应或酯化反应
【解析】解:A可以作水果的催熟剂,D是食醋的主要成分,则A是CH2=CH2 , D是CH3COOH,A和水发生加成反应生成B为CH3CH2OH,B被催化氧化生成C为CH3CHO,C被氧化生成乙酸D,B和D发生酯化反应生成E为CH3COOCH2CH3 , (1)通过以上分析知,A为CH2=CH2 , 反应①的反应类型是加成反应,所以答案是:CH2=CH2;加成反应;(2)C为CH3CHO,名称是乙醛,所以答案是:乙醛;(3)乙酸和乙醇在浓硫酸作催化剂、加热条件下发生酯化反应生成乙酸乙酯,所以反应③的化学方程式为 CH3CH2OH+CH3COOH ![]() CH3COOCH2CH3+H2O,该反应类型是取代反应或酯化反应,所以答案是:CH3CH2OH+CH3COOH
CH3COOCH2CH3+H2O,该反应类型是取代反应或酯化反应,所以答案是:CH3CH2OH+CH3COOH ![]() CH3COOCH2CH3+H2O; 取代反应(酯化反应).
CH3COOCH2CH3+H2O; 取代反应(酯化反应).


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.在恒温条件下,将一定量X和Y的混合气体通入一容积为2 L的密闭容器中,X和Y两物质的浓度随时间变化情况如下图。
(1)该反应的化学方程式为(反应物或生成物用符号X、Y表示):。
(2)0~10min化学反应速度V(X)=。
(3)比较Y在0~10min和10~20min时平均反应速率的大小:v(0~10) v(10~20)(填“<”、“>”或“=”),原因是。
(4)a、b、c、d四个点中,表示化学反应处于平衡状态的点是 , 理由是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】均由两种短周期元素组成的A、B、C、D化合物分子,都含有18个电子,它们分子中所含原子的数目依次为2、3、4、6。A和C分子中的原子个数比为1:1,B和D分子中的原子个数比为1:2。D可作为火箭推进剂的燃料。请回答下列问题。
(1)A、B、C、D分子中相对原子质量较大的四种元素第一电离能由大到小排列的顺序为(用元素符号回答)。
(2)A与HF相比,其熔、沸点较低,原因是。
(3)B分子的立体构型为形,该分子属于分子(填“极性”或“非极性”)。由此可以预测B分子在水中的溶解度较(“大”或“小”)。
(4)A、B两分子的中心原子的最高价氧化物对应的水化物的酸性强弱为(填化学式)。
若设A的中心原子为X,B的中心原子为Y,比较下列物质的酸性强弱(填“>”“<”或“=”):
HXOHXO3HXO4;
H2YO3H2YO4。
(5)D分子中心原子的杂化方式是 , 由该原子组成的单质分子中包含个π键,与该单质分子互为等电子体的常见分子的分子式为。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在反应2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O中,氧化剂是 , 氧化产物是 , 氧化产物与还原产物物质的量之比是 , 被氧化与未被氧化的HCl的质量之比为 , 若有7.3g HCl被氧化,则产生Cl2的质量为g,转移的电子数为mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W,X,Y,Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料.Z的非金属性在同周期元素中最强.下列说法正确的是( ) 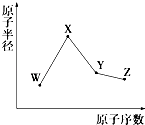
A.对应简单离子半径:X>W
B.对应气态氢化物的稳定性:Y>Z
C.化合物XZW既含离子键,又含共价键,属于弱电解质
D.Y的氧化物和Z的氢化物均能与X的最高价氧化物对应的水化物反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】核外电子数相同、所显电性和所带电量也相同的微粒称为等电子等质子体。下列各组内的两种微粒属于等电子等质子体的是( )
A. Na+、Mg2+ B. O2-、Mg2+
C. F-、Cl- D. Na+、NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,10mL 0.40mol/L H2O2溶液发生催化分解,不同时刻测得生成O2的体积(已折算为标准状况)如下表.
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)( )
A.0~6 min的平均反应速率:v(H2O2)≈3.3×10﹣2 mol/(Lmin)
B.6~10 min的平均反应速率:v(H2O2)<3.3×10﹣2 mol/(Lmin)
C.反应到6 min时,H2O2分解了50%
D.反应到6 min时,c(H2O2)=0.30 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置进行以下实验,能达到实验目的是( )
X | Y | Z | 目的 | 装置 | |
A | 甲苯 | KMnO4溶液 | 稀硫酸 | 证明甲基对苯环的性质存在影响 |
|
B | FeCl3溶液 | KSCN溶液 | 饱和KCl溶液 | 证明增大反应物浓度化学平衡向正反应方向移动 | |
C | 1mol/LNaOH | 1﹣氯丁烷5mL | 2%AgNO3 | 证明1﹣氯丁烷中含有氯元素 | |
D | 0.1mol/LNaCl | 0.1mol/LAgNO3溶液1mL | 0.1mol/LNa2S | 证明AgCl大于Ag2S的溶解度 |
A.A
B.B
C.C
D.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com