
����Ŀ����ϩ����Ҫ����ԭ�ϣ��������һ������ʯ�ͻ���ˮƽ�ı�־��ͨ��ʯ���ѽ���Ի����ϩ��������ϩΪԭ�ϻ����Ժϳɺܶ�Ļ�����Ʒ����֪��ϩ�ܷ�������ת����
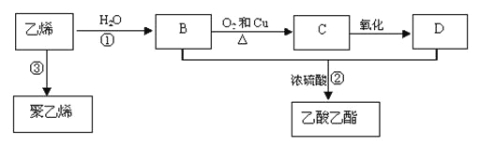
��1����ϩ�Ľṹ��ʽΪ ��
��2����Ӧ���ķ�Ӧ������ ��D�к�����������Ϊ ��
��3��д�����·�Ӧ�Ļ�ѧ����ʽ��[x�� ���� ���� ��
��4����ϩ�������������������飬����������Ҫ�����֣�
����һ��![]()
���ն���![]()
������ɫ��ѧ��ԭ�����������������ԭ�Ӿ����Ժõķ�Ӧ����ʵ�������У�Ӧ����___________����������һ���������ն������������������á�
���𰸡���1��CH2=CH2
��2���ӳɷ�Ӧ���Ȼ�
��3��CH2=CH2+H2O ![]() CH3CH2OH
CH3CH2OH
C2H5OH+CH3COOH![]() CH3COOC2H5+H2O
CH3COOC2H5+H2O
![]()
��4�����ն�
��������
�����������ϩ�����Ӿ۷�Ӧ�õ�����ϩ����ϩ��ˮ�����ӳɷ�Ӧ����BΪCH3CH2OH���Ҵ���Cu�����������·���������Ӧ����CΪCH3CHO��CH3CHO�ɽ�һ�������õ�DΪCH3COOH��CH3CH2OH��CH3COOH��Ũ���������·���������Ӧ����CH3COOCH2CH3����1����ϩ����̼̼˫�����ṹ��ʽΪCH2=CH2���ʴ�Ϊ��CH2=CH2����2����Ӧ������ϩ��ˮ�����ӳɷ�Ӧ�����Ҵ���DΪCH3COOH��������������Ϊ���Ȼ����ʴ�Ϊ���ӳɷ�Ӧ���Ȼ�����3����Ӧ����ϩ��ˮ�ӳɷ�Ӧ�����Ҵ�����Ӧ�ķ���ʽΪCH2=CH2+H2O ![]() CH3CH2OH��
CH3CH2OH��
��Ӧ���Ҵ������ᷢ��������Ӧ����������������Ӧ�ķ���ʽΪC2H5OH+CH3COOH![]() CH3COOC2H5+H2O����Ӧ����ϩ���Է����Ӿ۷�Ӧ���ɾ���ϩ����ӦΪ��
CH3COOC2H5+H2O����Ӧ����ϩ���Է����Ӿ۷�Ӧ���ɾ���ϩ����ӦΪ��![]() ��4���ɷ�Ӧ�����֪�����ն�ԭ��������Ϊ100%����ʵ�������У�Ӧ���ù��ն��������������ã��ʴ�Ϊ�����ն���
��4���ɷ�Ӧ�����֪�����ն�ԭ��������Ϊ100%����ʵ�������У�Ӧ���ù��ն��������������ã��ʴ�Ϊ�����ն���


 ����С����ͬ������ϵ�д�
����С����ͬ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���У���ȷ����( )
A. �����ڱ��У������������ڸ���Ԫ�ص�����������
B. �ǽ�������ǿ��Ԫ�أ�������������Ӧˮ�����������ǿ
C. ±�ص�����ԭ���������������۷е�����
D. �������ԭ���������������۷е�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.ij�¶���,��2 L������3�����ʼ���з�Ӧ,X��Y��Z�����ʵ�����ʱ��ı仯������ͼ����Ӧ��t1 minʱ����ƽ��,��ͼ��ʾ:
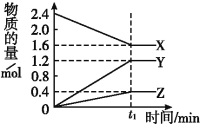
��1���÷�Ӧ�Ļ�ѧ����ʽ�� ��
��2������������Ӧ��X��Y��Z�ֱ�ΪNH3��H2��N2,����֪1 mol �����ֽ�ɵ���������Ҫ����46 kJ������,����t1 minʱ,�÷�Ӧ���յ�����Ϊ ;�ڴ�t1 minʱ����,��H2��ʾ��Ӧ��ƽ������v��H2��Ϊ ��
��. �������ƺ͵������������Һ�ﷴӦ�Ļ�ѧ����ʽ�ǣ�
5Na2SO3+2KIO3+H2SO4 ===5Na2SO4+K2SO4+I2+H2O��
�÷�Ӧ���̺ͻ����ϸ��ӣ�һ����Ϊ��Ϊ���¼�����
��IO3-+SO32-��IO2-+SO42-������
��IO2-+2SO32-��I-+2SO42-���죩
��5I-+6H++IO3-��3I2+3H2O������
��I2+SO32-+H2O��2I-+SO42-+2 H+������
��1���������������Ʋ⣬�˷�Ӧ���ܵķ�Ӧ������ ����Ӧ����������١��ڡ��ۡ��ܡ�����
��2����Ԥ�ȼ��������Һ����������,������ ����������ʱ���Ż�ʹ���۱��������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������G��![]() ����һ�����ϣ�һ�ֺϳ�·�����£�
����һ�����ϣ�һ�ֺϳ�·�����£�

��֪������Ϣ��
��![]() ��
��
��CΪ��ȩ��ͬϵ���ͬ���������������������ܶȱ�Ϊ22���ش��������⣺
��1��A�Ļ�ѧ����Ϊ ��
��2��B��C��Ӧ����D�Ļ�ѧ����ʽΪ ��
��3��F�к��й����ŵ�����Ϊ ��
��4��E��F��Ӧ����G�Ļ�ѧ����ʽΪ ��
��Ӧ����Ϊ ��
��5��F��ͬ���칹���в���������Ʒ�Ӧ���������Ĺ��� �֣������������칹�������к˴Ź�������ֻ������壬�ҷ������Ϊ3:1��Ϊ ��д�ṹ��ʽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��

��1��A�й����Լ��� ��B����ʢ��Һ������ ��C����ʢ��Һ������ ������ĸ��
a�������� b��̼������ c�������� d��̼����
��2��д��C�з�Ӧ�����ӷ���ʽ�ǣ� ��
��3����ͬѧ��Ϊû��Bװ�ã�Ҳ������֤���Ե�ǿ��������Ϊ����˵��������˵��������ɣ� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ۺ����ü������ڽ�Լ��Դ���������ڱ���������ʵ�������÷����ɵ�ص�ͭñ��Zn��Cu�ܺ���ԼΪ99%������ͭ���Ʊ�ZnO�IJ���ʵ�����������
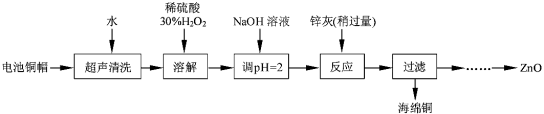
��1����д��ͭñ�ܽ������з�����Ӧ�Ļ�ѧ����ʽ ��
��ͭñ�ܽ���轫��Һ�й���H2O2��ȥ����ȥH2O2�ļ�㷽���� ��
��2��Ϊȷ������п������Ҫ�ɷ�ΪZn��ZnO������Ϊ��������������������ʵ������ⶨ��ȥH2O2����Һ��Cu2���ĺ�����ʵ�����Ϊ��ȷ��ȡһ������ĺ���Cu2������Һ�ڴ�����ƿ�У�������ˮϡ�ͣ�����pH=3��4���������KI����Na2S2O3����Һ�ζ����յ㡣���������е����ӷ���ʽ���£�
2Cu2����4I��=2CuI����ɫ������I2 I2��2![]() =2I����
=2I����![]()
���ζ�ѡ�õ�ָʾ��Ϊ ���ζ��յ�۲쵽������Ϊ ��
�����ζ�ǰ��Һ��H2O2û�г�������������Cu2���ĺ������� ���ƫ�ߡ�����ƫ�͡��������䡱����
��3����֪pH��11ʱZn��OH��2������NaOH��Һ����[Zn��OH��4]2�����±��г����������������������������pH����ʼ������pH����������Ũ��Ϊ1.0 mol��L��1������
Fe3�� | Fe2�� | Zn2�� | |
��ʼ������pH | 1.1 | 5.8 | 5.9 |
��ȫ������pH | 3.2 | 8.8 | 8.9 |
ʵ���п�ѡ�õ��Լ���30% H2O2��1.0 mol��L��1HNO3��1.0 mol��L��1 NaOH��
������ͭ������Һ�Ʊ�ZnO��ʵ�鲽������Ϊ��
�� ��
�� ��
�� ���ˣ�
�� ��
�� ���ˡ�ϴ�ӡ�����
�� 900�����ա�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧС������ͼ��ʾװ����֤±�ص��������Ե����ǿ��������˵������ȷ����( )
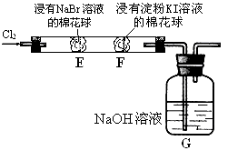
A��E�������ɻ�ɫ��˵��Cl2�������Ա�Br2ǿ
B��F����������ɫ��˵��Br2�������Ա�I2ǿ
C��E��������Ӧ�����ӷ���ʽΪ��Cl2+ 2Br����2Cl��+ Br2
D��Gװ����NaOH��Һ��Cl2��Ӧ�����ӷ���ʽΪ��2OH�� + Cl2 = ClO��+ Cl��+ H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ǿ������Һ���ܴ�������������ǣ� ��
A��S2�� B��AlO2�� C��HCO3�� D��NH4+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������ʵľ����У���ѧ�����ͺ;������Ͷ���ͬ����
A��CO2��H2S B��KOH��CH4 C��Si��CO2 D��NaCl��HCl
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com