
����Ŀ���¶�ΪTʱ����2.0L�����ܱ������г���1.0 mol PCl5����ӦPCl5(g)![]() PCl3(g)��Cl2(g)��һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ�IJ������ݼ��±�������˵����ȷ����
PCl3(g)��Cl2(g)��һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ�IJ������ݼ��±�������˵����ȷ����
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/ mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
A����Ӧ��ǰ50 s��ƽ������Ϊv(PCl3)=0.0032mol��L��1��s��1
B�����������������䣬�����¶ȣ�ƽ��ʱc(PCl3)=0.11mol��L��1����Ӧ����H��0
C����ͬ�¶��£���ʼʱ�������г���1.0mol PCl5��0.20mol PCl3��0.20molCl2���ﵽƽ��ǰv(��)��v(��)
D����ͬ�¶��£���ʼʱ�������г���2.0mol PCl3��2.0molCl2���ﵽƽ��ʱ��PCl3��ת����С��80%
���𰸡�C
��������A��ɱ������ݿɵã�ǰ50sƽ������v(PCl3)=0.16mol��2.0L��50s=0.0016molL��1s��1����A����B��ɱ������ݿɵã�ԭƽ��c(PCl3)=0.20mol��2.0L=0.10molL��1����Ϊ���������������䣬�����¶ȣ��ٴ�ƽ��ʱ��c(PCl3)=0.11molL��1����������ƽ�����ƣ���H>0����B����C����ݱ�������������ʽ�ã�
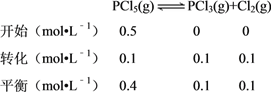
����ƽ�ⳣ��K=![]() =
=![]() =0.025������ͬ�¶��£���ʼʱ�������г���1.0mol PCl5��0.20mol PCl3��0.20mol Cl2����Q=
=0.025������ͬ�¶��£���ʼʱ�������г���1.0mol PCl5��0.20mol PCl3��0.20mol Cl2����Q=![]() =
=![]() =0.02��Q<K����ʱƽ�������ƶ���v(��)>v(��)����C����D�ԭƽ��ɵ�ЧΪ��ʼ״̬Ϊ1.0mol PCl3��1.0mol Cl2��PCl3��ƽ��ת����Ϊ��1.0-0.20����1.0��100%=80%����ͬ�¶��£�����ʼʱ�������г���2.0mol PCl3��2.0mol Cl2���ﵽ��ƽ����ԭƽ�ⲻ��Ч����Ϊ����ѹǿƽ�����淴Ӧ�����ƶ�������PCl3��ת��������PCl3��ת���ʣ�80%��D��ȷ��
=0.02��Q<K����ʱƽ�������ƶ���v(��)>v(��)����C����D�ԭƽ��ɵ�ЧΪ��ʼ״̬Ϊ1.0mol PCl3��1.0mol Cl2��PCl3��ƽ��ת����Ϊ��1.0-0.20����1.0��100%=80%����ͬ�¶��£�����ʼʱ�������г���2.0mol PCl3��2.0mol Cl2���ﵽ��ƽ����ԭƽ�ⲻ��Ч����Ϊ����ѹǿƽ�����淴Ӧ�����ƶ�������PCl3��ת��������PCl3��ת���ʣ�80%��D��ȷ��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������β���ﺬ��NO������������ȼ��ȼ�յĸ�����������������Ӧ����:N2(g)+O2(g)![]() 2NO(g)����H>0����֪�÷�Ӧ��2 404 ��ʱ,ƽ�ⳣ��K=64��10-4����ش�:
2NO(g)����H>0����֪�÷�Ӧ��2 404 ��ʱ,ƽ�ⳣ��K=64��10-4����ش�:
��1��ij�¶���,��2 L���ܱ������г���N2��O2��1 mol,5���Ӻ�O2�����ʵ���Ϊ0.5 mol,��N2�ķ�Ӧ����Ϊ___��
��2���ٶ��÷�Ӧ���ں��������½���,�жϸ÷�Ӧ�ﵽƽ��ı�־___(����ĸ���)��
A.����1 mol N2ͬʱ����1 mol O2
B.��������ܶȲ���
C.�������ƽ����Է�����������
D.2v��(N2)=v��(NO)
��3����N2��O2�Ļ�����������º����ܱ�������,���б仯������ȷ����__(����ĸ���)��

��4������º��ݵ��ܱ������г�������ʵ�����N2��O2,�ﵽƽ��״̬���������г���һ����NO,���´ﵽ��ѧƽ��״̬����ԭƽ��״̬���,��ʱƽ����������NO���������_____(�������������С������������)��
��5�����¶���,ijʱ�̲��������N2��O2��NO��Ũ�ȷֱ�Ϊ2.5��10-1 mol��L-1��4.0��10-2 mol��L-1��3.0��10-3 mol��L-1,��ʱ��Ӧ________________(�������ڻ�ѧƽ��״̬����������Ӧ����������������淴Ӧ���������),������_______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������Ȫʵ�飬�������ð���(����)
A. ��Һ�� B. �ȿ����� C. ��������ˮ D. �ܸ�ˮ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A+B��X+Y+H2O��δ��ƽ����Ӧ������ȥ������ѧ������Ӧ�Ļ�ѧ����ʽ����ش�
��1����YΪ����ɫ���壺
�ٵ�A��B�����ʵ���֮��Ϊ1��4��AΪ��ɫ����ʱ���÷�Ӧ�����ӷ���ʽ����
�ڵ�A��B�����ʵ���֮��Ϊ1��6ʱ��д���÷�Ӧ�Ļ�ѧ����ʽ������˫���ű�ʾ��Ӧ�����еĵ���ת�ƣ� ��
��ʵ���Ҵ���β��Yʱ����NaOH������NaHSO3��Һ����ԭ���ǣ������ӷ�Ӧ����ʽ��ʾ�� ��
��2����AΪ���ʣ�BΪ��ɫ��״��Һ�壬�� A��B�����ʵ���֮��Ϊ1��2ʱ����A����Ϊ �� ������д̼����������X�ķ����� ��
��3��������A��B��Ũ��Һ�лᡰ�ۻ�������A������X��Һ�У���AΪ�������ʣ�A��B�����ʵ���֮��1��4��Ӧ��
�ٹ�����A��100mL2mol/L��B��Һ��ַ�Ӧ����Һϡ����500mL����Һ�������ӵ����ʵ���Ũ��Ϊ ��
�ں� a mol X����Һ�ܽ���һ����A������Һ�����ֽ��������ӵ����ʵ���֮��Ϊ1��2ʱ����ԭ��X��mol��
��4����A��B��X��Y��Ϊ�������A��Һ�м��������ữ��AgNO3��Һ��������ɫ������B����ɫΪ��ɫ����A��B�����ʵ���֮��1��4��Ӧ����Һ�����ʵĻ�ѧʽΪ ��
��5����A��B��X��Y��Ϊ�����XΪ��������ˮ�����壬����A���Σ���������X�����ӷ���ʽΪ �� ���������ķ����� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪: 25�桢101 kPa�£��� 2 Na(s) + 1/2 O2(g) = Na2O(s) ��H1 = - 414 kJ / mol
�� 2 Na(s) + O2(g) = Na2O2(s) ��H2 = - 511 kJ / mol
����˵����ȷ����
A. ������������������Ӹ����Ȳ����
B. ���������ɵ����ʵ����IJ��ת�Ƶ�������ͬ
C. ������Na������O2��Ӧ����Na2O�����¶���������Na2O�������ӿ�
D. 25�桢101 kPa�£�Na2O2(s) + 2 Na(s) = 2 Na2O(s) ��H = -317 kJ / mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����п������õİ�ͷ����������H�ĺϳ�·������ͼ��ʾ��

��֪��
![]()
(1)A���ڷ���������������___________________��
(2)B�Ľṹ��ʽ��____________________________��
(3)��C����D�Ļ�ѧ����ʽ��___________________________________________��
(4)��E��I2��һ�������·�Ӧ����F�Ļ�ѧ����ʽ��____________________________���˷�Ӧͬʱ��������һ���л�����������F��Ϊͬ���칹�壬���л�������Ľṹ��ʽ��_____________________________________��
(5)�Լ�b��_____________________________��
(6)����˵����ȷ����___________��ѡ����ĸ��ţ���
a. G����˳���칹��
b. ��G����H�ķ�Ӧ�Ǽӳɷ�Ӧ
c. 1 mol G��������1 mol H2�����ӳɷ�Ӧ
d. 1 mol F��1 mol H������NaOH��Һ��Ӧ��������2 molNaOH
(7)����ϩΪ��ʼԭ�ϣ������֪��Ϣѡ�ñ�Ҫ�����Լ��ϳɣ�д���ϳ� ��·�ߣ��ýṹ��ʽ��ʾ�л���ü�ͷ��ʾת����ϵ����ͷ��ע���Լ��ͷ�Ӧ������_______��
��·�ߣ��ýṹ��ʽ��ʾ�л���ü�ͷ��ʾת����ϵ����ͷ��ע���Լ��ͷ�Ӧ������_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������пƬ��Ӧ����ʼʱ��Ӧ����������
A��10 �� 20 mL 3 mol/L������ B��10 �� 40 mL 2 mol/L������
C��20 �� 20 mL 2 mol/L������ D��20 �� 10 mL 4 mol/L������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���ݻ��̶����ܱ������У�������Ӧ��CO(g)��2H2(g)![]() CH3OH(g)����H<0����2 minʱֻ�ı�һ����������Ӧ������±���
CH3OH(g)����H<0����2 minʱֻ�ı�һ����������Ӧ������±���
ʱ�� | c(CO)/mol/L | c(H2)/mol/L | c(CH3OH)/mol/L |
��ʼ | 1 | 3 | 0 |
��2 min | 0.8 | 2.6 | 0.2 |
��4 min | 0.4 | 1.8 | 0.6 |
��6 min | 0.4 | 1.8 | 0.6 |
����˵������ȷ����(����)
A. ��4 min����6 min�û�ѧ��Ӧ����ƽ��״̬
B. ��2 minʱ�����ֻ�ı�ijһ��������ı�����������ǽ����¶�
C. ��2 minʱ�����ֻ�ı�ijһ��������ı������������ʹ�ô���
D. ��6 minʱ�������������䣬��������¶ȣ�����Ӧ��������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com