
【题目】氢能源是一种重要的清洁能源。现有两种可产生H2的化合物甲和乙。将6.00 g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72 LH2(已折算成标准状况)。甲与水反应也能产生H2,同时还产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液。化合物乙在催化剂存在下可分解得到H2和另一种单质气体丙,丙在标准状态下的密度为1.25 g/L。请回答下列问题:
(1)甲的化学式是_________;乙的电子式是__________。
(2)甲与水反应的化学方程式是__________________________________
(3)气体丙与金属镁反应的产物是_______(用化学式表示)。
(4)乙在加热条件下与CuO反应可生成Cu和气体丙,写出该反应的化学方程式
___________________________________________________________________
有人提出产物Cu中可能还含有Cu2O,请设计实验方案验证之(已知Cu2O+2H+==Cu+Cu2++H2O)___________________________________________________________
(5)甲与乙之间_______(填“可能”或“不可能)发生反应产生H2,判断理由是_______
【答案】 AlH3 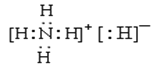 2AlH3+6H2O==2Al(OH)3+6H2↑ Mg3N2 2NH4H+5CuO
2AlH3+6H2O==2Al(OH)3+6H2↑ Mg3N2 2NH4H+5CuO![]() 5Cu+ N2↑+5H2O 取少量反应产物,滴加足量稀硫酸,若溶液由无色变为蓝色,证明产物Cu中含有Cu2O;若溶液不变蓝色,证明产物Cu中不含Cu2O 可能 AlH3中氢元素的化合价为-1价,NH4H中含有+1价的氢元素,二者可发生氧化还原反应产生H2
5Cu+ N2↑+5H2O 取少量反应产物,滴加足量稀硫酸,若溶液由无色变为蓝色,证明产物Cu中含有Cu2O;若溶液不变蓝色,证明产物Cu中不含Cu2O 可能 AlH3中氢元素的化合价为-1价,NH4H中含有+1价的氢元素,二者可发生氧化还原反应产生H2
【解析】白色沉淀可溶于NaOH溶液,应为Al(OH)3 ,说明甲中含有Al和H两种元素,n(H2)=![]() ==0.3mol,则m(H)=0.3mol×2×1g·mol-1=0.6g,则6.00g甲中含有m(Al)=6.00g-0.6g=5.4g,n(Al)=
==0.3mol,则m(H)=0.3mol×2×1g·mol-1=0.6g,则6.00g甲中含有m(Al)=6.00g-0.6g=5.4g,n(Al)=![]() ==0.2mol,所以n(Al):n(H)=0.2mol:0.6mol=1:3,则甲的化学式为AlH3,丙在标准状况下的密度为1.25g·L-1,则丙的相对原子质量为1.25g·L-1×22.4L=28,应为N2,则乙为NH4H,(1)由以上分析可知甲为AlH3,乙为NH4H,电子式为
==0.2mol,所以n(Al):n(H)=0.2mol:0.6mol=1:3,则甲的化学式为AlH3,丙在标准状况下的密度为1.25g·L-1,则丙的相对原子质量为1.25g·L-1×22.4L=28,应为N2,则乙为NH4H,(1)由以上分析可知甲为AlH3,乙为NH4H,电子式为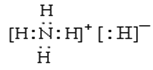 ;(2)AlH3与水发生氧化还原反应,化学方程式是2AlH3+6H2O==2Al(OH)3+6H2↑;(3)气体丙为N2与金属镁反应的产物是Mg3N2 ;(4)NH4H在加热条件下与CuO反应可生成Cu和气体N2,反应的方程式为2NH4H+5CuO
;(2)AlH3与水发生氧化还原反应,化学方程式是2AlH3+6H2O==2Al(OH)3+6H2↑;(3)气体丙为N2与金属镁反应的产物是Mg3N2 ;(4)NH4H在加热条件下与CuO反应可生成Cu和气体N2,反应的方程式为2NH4H+5CuO![]() 5Cu+ N2↑+5H2O,要判断产物中是否含有CuO,可加入稀硫酸检验溶液是否变蓝,方法是取样后加H2SO4溶液,如果溶液变蓝,说明产物中含有Cu2O,反之则无Cu2O;(5)甲与乙之间可能发生反应产生H2,判断理由是:AlH3中氢元素的化合价为-1价,NH4H中含有+1价的氢元素,二者可发生氧化还原反应产生H2。
5Cu+ N2↑+5H2O,要判断产物中是否含有CuO,可加入稀硫酸检验溶液是否变蓝,方法是取样后加H2SO4溶液,如果溶液变蓝,说明产物中含有Cu2O,反之则无Cu2O;(5)甲与乙之间可能发生反应产生H2,判断理由是:AlH3中氢元素的化合价为-1价,NH4H中含有+1价的氢元素,二者可发生氧化还原反应产生H2。


科目:高中化学 来源: 题型:
【题目】某同学完成如下探究实验:
实验目的:比较Cl2、Br2、I2三种单质的氧化性强弱
实验药品:NaBr溶液、KI溶液、氯水、淀粉溶液
实验记录:
实验步骤 | 实验现象 | 实验结论 |
| 溶液变为橙黄色 | Ⅰ________ |
| 溶液变为黄色 | 氧化性:Br2>I2 |
| Ⅱ___________ |
反思与评价:
(1)Ⅰ________;Ⅱ________。
(2)步骤①反应的离子方程式为:________。
(3)检验②中所得黄色溶液含I2的另一种方法是(简述实验操作和相应的实验现象)________。
(4)你认为上述实转设计(填“能”或“不能)____达到实验目的,理由是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 光催化还原水制氢比电解水制氢更节能环保、更经济
B. 氨氮废水(含NH4+及NH3)可用化学氧化法或电化学氧化法处理
C. 某种光学检测技术具有极高的灵敏度,可检测到单个细胞(V≈10-12L)内的数个目标分子,据此可推算该检测技术能测量到细胞内浓度约为10-12~10-11mol/L的目标分子
D. 向汽油中添加甲醇后,该混合燃料的热值不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各装置图的叙述中,错误的是( )

A. 实验室用装置①蒸馏石油
B. 装置②中X若为四氯化碳,可用于吸收氨气,并防止倒吸
C. 装置③可用于制备氢氧化亚铁并观察其颜色
D. 装置④是电解精炼铜,b极为粗铜,发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有FeO、Fe2O3、Fe3O4组成的混合物mg,向其中加入l00mL2mol/L硫酸,恰好完全溶解,若mg该混合物在过量CO气流中加热充分反应,则冷却后剩余固体的质量为
A. (m-1.6)g B. (m-2.4)g C. (m-3.2)g D. 无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】BaCl2·xH2O中结晶水数目可通过重量法来确定:
①称取1.222g样品,置于小烧杯中,加入适量稀盐酸,加热溶解,边搅拌边滴加稀硫酸到沉淀完全,静置;
②过滤并洗涤沉淀;
③将盛有沉淀的滤纸包烘干并中温灼烧;转入高温炉中,反复灼烧到恒重,称得沉淀质量为1.165g。
回答下列问题:
(1)在操作②中,需要先后用稀硫酸和____________ 洗涤沉淀;检验沉淀中氯离子是否洗净的方法是____________ 。
(2)计算BaCl2·xH2O中的x=__________ 。
(3)操作③中,如果空气不充足和温度过高,可能会有部分沉淀被滤纸中的碳还原为BaS,这使x的测定结果__________ (填“偏低”、“偏高”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的工业制法中,错误的是
A. 制硅:用焦炭还原二氧化硅得硅
B. 制钠:以海水为原料制得NaCl,再电解熔融NaCl得钠
C. 制铁:以焦炭和铁矿石为原料,用CO还原铁矿石得铁
D. 制镁:以海水为原料,经一系列过程制得氯化镁,用H2还原MgCl2得镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是(NA为阿伏加德罗常数) ( )
A. 电解CuCl2溶液,阴极析出16g铜时,电极上转移的电子数为NA
B. 12 g石墨中含有C—C键的个数为1.5NA
C. 12 g金刚石中含有C—C键的个数为4NA
D. SiO2晶体中每摩尔硅原子可与氧原子形成2NA个共价键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com