
【题目】氢能源是最具应用前景的能源之一。可利用太阳能光伏电池电解水制高纯氢,工作原理如图所示(电极l、电极2均为惰性电极)。下列说法错误的是
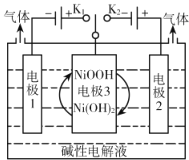
A.控制连接开关K1或K2,可交替得到H2和O2
B.碱性电解液改为酸性电解池能达到同样目的
C.接通K1时电极3上的电极反应式为Ni(OH)2+OH--e-=NiOOH+H2O
D.电极3在交替连接K1或K2过程中得以循环使用
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某学习小组用0.80 mol/L标准浓度的烧碱溶液测定未知浓度的盐酸。
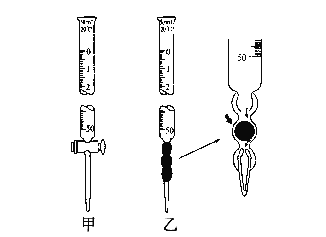
(1).滴定管如图所示,用______滴定管盛装标准浓度的氢氧化钠溶液 (填“甲”或“乙”)。
(2).用滴定的方法来测定盐酸的浓度,实验数据如下所示:
实验编号 | 待测HCl溶液的体积/mL | 滴入NaOH溶液的体积/mL |
1 | 20.00 | 23.00 |
2 | 20.00 | 23.10 |
3 | 20.00 | 22.90 |
该实验中用去标准液的体积为________ml。
(3).下列操作会使所测得的盐酸的浓度偏低的是________。
A.盛装待测液的锥形瓶用水洗后未干燥
B.滴定前,碱式滴定管尖端有气泡,滴定后气泡消失
C.碱式滴定管用蒸馏水洗净后,未用标准氢氧化钠溶液润洗
D.读碱式滴定管的刻度时,滴定前仰视凹液面最低处,滴定后俯视读数
(4).滴定过程中,眼睛应注视________;在铁架台上垫一张白纸,其目的是_______________;
若用酚酞作指示剂,则判断达到滴定终点时的现象是__________________。
(5).根据上表数据,计算被测盐酸的物质的量浓度是________mol/L。(小数点后保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为人体内肾上腺素合成的简化过程。下列叙述正确的是( )
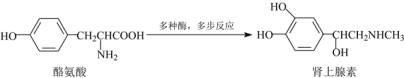
A.每个肾上腺素分子中含有3个酚羟基
B.酪氨酸和肾上腺素都能发生取代、加成和消去反应
C.用NaHCO3溶液和FeCl3溶液均可鉴别酪氨酸和肾上腺素
D.酪氨酸在一定条件下,可以发生缩聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.1g镁铝合金的粉末放入过量的盐酸中,得到2.24LH2(标准状况下)。计算:
(1)反应得到H2的物质的量为_______mol;
(2)该合金中镁的质量分数_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对羟基苯甲酸乙酯用于食品防腐剂,工业上可用下列方法制备,以下说法错误的是
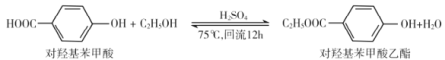
A.对羟基苯甲酸能发生缩聚反应、取代反应B.可用浓溴水检验产物中是否有对羟基苯甲酸乙酯生成
C.lmol对羟基苯甲酸乙酯最多与2molNaOH反应D.乙醇脱水生成的乙烯不存在顺反异构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠、铝和铁是三种重要的金属。请回答:
(1)请画出钠的原子结构示意图_______ ,根据钠的原子结构示意图可得出钠的哪些性质?(写出一条)_________。
(2)这三种金属的金属活动性由强到弱的顺序是_________ 。
(3)小块金属钠投入水中,发生反应的化学方程式为_______________;可观察到的实验现象是_________ (填字母)。
a.钠沉到水底 b.钠熔成小球 c.小球四处游动d.水变红色
(4)铝与稀硫酸反应的离子方程式为_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列括号内的气体是需要检验的杂质,检验的方法合理的是( )
A.H2、CO2(CO)![]()
![]()
B.H2(CO2、HCl) ![]()
![]()
C.O2(CO) ![]()
![]()
D.CO(H2O、CO2) ![]()
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】450℃时,在某恒容密闭容器中存在反应:C(s)+2NO(g)![]() N2(g)+CO2(g),下列说法能作 为判断该反应达到化学平衡状态标志的是
N2(g)+CO2(g),下列说法能作 为判断该反应达到化学平衡状态标志的是
A. 容器内压强保持不变B. v正(N2)=2v逆(NO)
C. N2与CO2的物质的量之比为1∶1D. 容器内混合气体的密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行A(g)+2B(s)![]() 2C(s)+3D(s) ΔH>0的反应,下列说法正确的是( )
2C(s)+3D(s) ΔH>0的反应,下列说法正确的是( )
A. 升高温度,正反应速率增大,逆反应速率减小
B. 容器内气体平均相对分子质量不变时达到化学平衡状态
C. 温度不变,增大B的投入量,正反应速率增大
D. 温度不变,压缩容器体积重新达到平衡后,A的浓度不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com