
【题目】下表提供的试剂,用如图所示装置,能制备相应气体的是
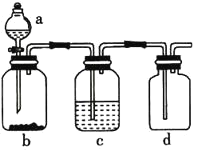
选项 | a中试剂 | b中试剂 | c中试剂 | 实验目的 |
A. | 浓盐酸 | 二氧化锰 | 饱和食盐水 | 制备并收集氯气 |
B. | 稀盐酸 | 石灰石 | 浓硫酸 | 制备并收集二氧化碳 |
C. | 稀硫酸 | 粗锌 | 浓硫酸 | 制备并收集氢气 |
D. | 稀硝酸 | 铜粉 | 浓硫酸 | 制备并收集一氧化氮 |
A.AB.BC.CD.D
科目:高中化学 来源: 题型:
【题目】有新合成的一种烃,其碳骨架呈三棱柱体(如图所示,碳碳键的键长相等)。
![]()
(1)写出该烃的分子式:________________。
(2)该烃的一氯代物有________种。
(3)该烃的四氯代物有________种。
(4)该烃的同分异构体有多种,其中一种不能使酸性高锰酸钾溶液褪色,但在一定条件下能跟液溴、氢气等发生反应,这种同分异构体的结构简式为________________。请写出该同分异构体与氢气反应的化学方程式并注明反应类型:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)“民以食为天,食以安为先”。近年来屡屡发生的 劣质奶粉、苏丹红、多宝鱼等食品安全事件严重威胁消费者的健康和生命安全。下列有关蛋白质的说法正确的是____________(填序号)。
A.蛋内质是重要的营养物质,也是提供人体所需能最的主要物质
B.蛋白质在淀粉酶的作用下,可水解成葡萄糖等
C.蛋白质水解的最终产物是氨基酸
(2)奶粉中蛋内质含量的国家标准是:每100 g婴幼儿奶粉中含蛋白质1225 g。其测定方法是:奶粉经水解产生氨基酸,再经过其他反应生成氨, 由氨的量计算出氮的量,再由氮的量求出蛋白质的含量(蛋白质含氮量按16%计算)。某市质检局取100 g市场中的某个品牌的奶粉样品进行检验。该样品进行反应后生成的![]() 和 7.5 g 19. 6%的稀硫酸恰好完全反应,通过计算可判断出这种奶粉__________(填“属于”或“不属于”)合格奶粉。
和 7.5 g 19. 6%的稀硫酸恰好完全反应,通过计算可判断出这种奶粉__________(填“属于”或“不属于”)合格奶粉。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组测定不同温度下、不同初始浓度的某溶液中R的水解速率,c(R)随时间的变化曲线如图。下列说法不正确的是
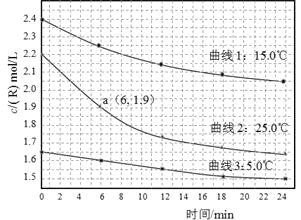
A.在0-6min之间,25℃时R的水解速率为0.05 mol·L—1·min—1
B.在0-24min之间,曲线3对应水解速率最小
C.由曲线1可以得出结论:其它条件不变,水解速率随浓度增大而增大
D.由曲线2、3可以得出结论:其它条件不变,水解速率随温度升高而增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下在密闭容器中发生如下可逆反应:2M(g)+N(g)![]() 2E(g),若开始时只充入2mol E(g),达平衡时,E的转化率为40%;若开始时充入2mol M和1mol N的混合气体,达平衡时混合气体的压强比起始时减少了( )
2E(g),若开始时只充入2mol E(g),达平衡时,E的转化率为40%;若开始时充入2mol M和1mol N的混合气体,达平衡时混合气体的压强比起始时减少了( )
A.20%B.40%C.60%D.80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产中产生的![]() 、NO直接排放将对大气造成严重污染.利用电化学原理吸收
、NO直接排放将对大气造成严重污染.利用电化学原理吸收![]() 和NO,同时获得
和NO,同时获得![]() 和
和![]() 产品的工艺流程图如下
产品的工艺流程图如下![]() 为铈元素
为铈元素![]() .
.

请回答下列问题.
![]() 装置Ⅱ中NO在酸性条件下生成
装置Ⅱ中NO在酸性条件下生成![]() 的离子方程式 ______ .
的离子方程式 ______ .
![]() 含硫各微粒
含硫各微粒![]() 、
、![]() 和
和![]() 存在于
存在于![]() 与NaOH溶液反应后的溶液中,它们的物质的量分数
与NaOH溶液反应后的溶液中,它们的物质的量分数![]() 与溶液pH的关系如图1所示.
与溶液pH的关系如图1所示.
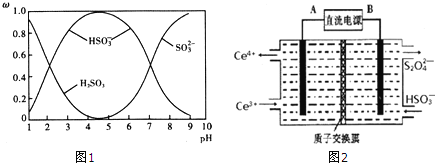
①下列说法正确的是 ______ ![]() 填标号
填标号![]() .
.
A ![]() 时,溶液中
时,溶液中![]()
![]()
![]()
B 由图中数据,可以估算出![]() 的第二级电离平衡常数
的第二级电离平衡常数![]()
C 为获得尽可能纯的![]() ,应将溶液的pH控制在
,应将溶液的pH控制在![]() 为宜
为宜
D ![]() 和
和![]() 时的溶液中所含粒子种类不同
时的溶液中所含粒子种类不同
②若![]() 的NaOH溶液完全吸收
的NaOH溶液完全吸收![]() 标况下
标况下![]() ,则反应的离子方程式为 ______ .
,则反应的离子方程式为 ______ .
③取装置Ⅰ中的吸收液vmL,用![]() 的酸性高锰酸钾溶液滴定.酸性高锰酸钾溶液应装在 ______
的酸性高锰酸钾溶液滴定.酸性高锰酸钾溶液应装在 ______ ![]() 填“酸式”或“碱式”
填“酸式”或“碱式”![]() 滴定管中,判断滴定终点的方法是 ______ .
滴定管中,判断滴定终点的方法是 ______ .
![]() 装置Ⅲ的作用之一是再生
装置Ⅲ的作用之一是再生![]() ,其原理如图2所示.图中A为电源的 ______
,其原理如图2所示.图中A为电源的 ______ ![]() 填“正”或“负”
填“正”或“负”![]() 极.右侧反应室中发生的主要电极反应式为 ______ .
极.右侧反应室中发生的主要电极反应式为 ______ .
![]() 已知进人装置Ⅳ的溶液中
已知进人装置Ⅳ的溶液中![]() 的浓度为
的浓度为![]() ,要使
,要使![]() 该溶液中的
该溶液中的![]() 完全转化为
完全转化为![]() ,需至少向装置Ⅳ中通入标准状况下的
,需至少向装置Ⅳ中通入标准状况下的![]() 的体积为 ______ L.
的体积为 ______ L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向1L的密闭容器中加入1mol X、0.3molZ和一定量的Y三种气体,一定条件下发生反应,各物质的浓度随时间变化如图一所示,图二为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。下列说法不正确的是
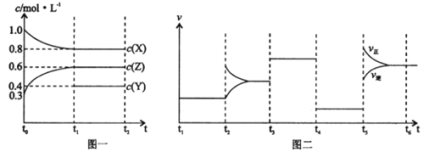
A.Y的起始物质的量为0.5mol
B.该反应化学方程式为:2X(g)+Y(g)![]() 3Z(g) ΔH<0
3Z(g) ΔH<0
C.若t0=0,t1=10min,则t0~t1阶段的平均反应速率为v(Z)=0.03mol·(L·min)-1
D.反应物X的转化率t6点比t3点高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物在有机合成、能源开发等工农业方面具有十分广泛的应用。
Ⅰ.在25℃、101kPa时,1.00g C6H6(l)燃烧生成CO2和H2O(l)时,放出41.8kJ的热量,表示C6H6(l)燃烧热的热化学方程式为___________________。
Ⅱ.乙二醇(HOCH2CH2OH)气相氧化法
已知:2H2(g)+O2(g) 2H2O(g)ΔH=-484kJ/mol
OHC-CHO(g)+2H2(g) HOCH2CH2OH(g) ΔH=-78kJ/mol
则乙二醇气相氧化反应HOCH2CH2OH(g)+O2(g) OHC-CHO(g)+2H2O(g)的ΔH=________;相同温度下,该反应的化学平衡常数K=____________(用含K1、K2的代数式表示)。
Ⅲ. 甲醇的合成。
(1)在一容积为2L的密闭容器内,充入0.2molCO与0.4molH2发生反应如下:CO(g)+2H2(g)CH3OH(g),CO的平衡转化率与温度,压强的关系如图所示。
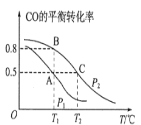
①A、B两点对应的压强大小关系是PA________PB(填“>、<、=”)。
②A、B、C三点的平衡常数KA,KB,KC的大小关系是__________。
③下列叙述能说明上述反应能达到化学平衡状态的是______________(填代号)。
a.H2的消耗速率是CH3OH生成速率的2倍 b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变 d.CO和CH3OH的物质的量之和保持不变
(2)在P1压强、T1℃时,经5min达到化学平衡,则用氢气表示该反应的化学速率v(H2)=______,再加入1.0molCO后重新到达平衡,则CO的转化率______(填“增大,不变,减小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铜电池放电过程的工作原理示意图如下所示,两电极参与反应的物质均含有铜元素![]() 已知:常温下,
已知:常温下,![]() ,
,![]() 。下列说法正确的是
。下列说法正确的是
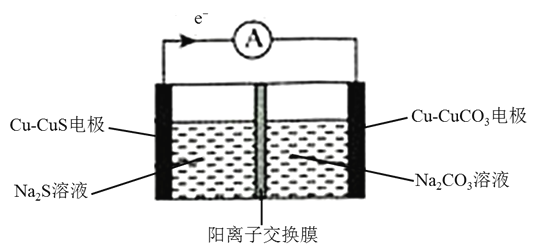
A.当溶液中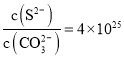 时,电池停止放电
时,电池停止放电
B.![]() 电极为负极,电极反应式为
电极为负极,电极反应式为![]()
C.放电过程中,![]() 溶液的浓度减小
溶液的浓度减小
D.该电池充电时,![]() 从阳离子交换膜的左侧向右侧扩散
从阳离子交换膜的左侧向右侧扩散
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com