
【题目】某研究小组测定不同温度下、不同初始浓度的某溶液中R的水解速率,c(R)随时间的变化曲线如图。下列说法不正确的是
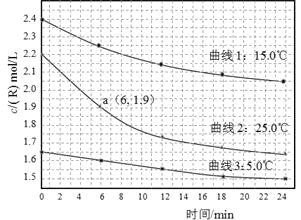
A.在0-6min之间,25℃时R的水解速率为0.05 mol·L—1·min—1
B.在0-24min之间,曲线3对应水解速率最小
C.由曲线1可以得出结论:其它条件不变,水解速率随浓度增大而增大
D.由曲线2、3可以得出结论:其它条件不变,水解速率随温度升高而增大
【答案】D
【解析】
A、在0-6min之间,25℃时R的浓度减少2.2-1.9=0.3mol/L,则R的水解速率为0.3mol/L÷6min=0.05 mol·L—1·min—1,正确;
B、在相同时间内曲线3的浓度的变化最小,所以水解速率最小,正确;
C、由曲线1可知,随反应的进行,R的浓度逐渐减小,在每个6min内浓度的变化越来越小,则水解速率逐渐减小,说明其它条件不变,水解速率随浓度增大而增大,正确;
D、曲线3的温度低于曲线2,浓度也低于曲线2,所以水解速率小于曲线2,不能说明水解速率随温度升高而增大,而曲线1与曲线2相比,曲线2的浓度低于曲线1,温度高于曲线1,在前12min内曲线2的水解速率却大于曲线1,说明水解速率随温度升高而增大,错误。
答案选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】吊白块( NaHSO2·HCHO·2H2O,M=154.0g/mol)在工业中有广泛应用;吊白块在酸性环境下、100℃即发生分解释放出HCHO。实验室制备吊白块的方案如下:
NaHSO3的制备:
如图,在广口瓶中加入一定量Na2SO3和水,振荡溶解,缓慢通入SO2,至广口瓶中溶液pH约为4,制得NaHSO3溶液。
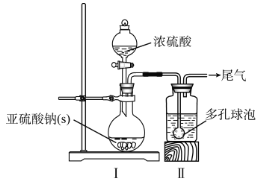
(1)装置Ⅰ中产生气体的化学反应方程式为__;Ⅱ中多孔球泡的作用是__。
(2)实验室检测NaHSO3晶体在空气中是否发生氧化变质的实验方案是__。
吊白块的制备:
如图,向仪器A中加入上述NaHSO3溶液、稍过量的锌粉和一定量甲醛,在80~90℃C下,反应约3h,冷却过滤。

(3)仪器A的名称为___;用恒压漏斗代替普通滴液漏斗滴加甲醛的优点是__。
(4)将仪器A中的反应温度恒定在80~90℃的目的是__。
吊白块纯度的测定:
将0.5000g吊白块样品置于蒸馏烧瓶中,加入10%磷酸10mL,立即通入100℃水蒸气;吊白块分解并释放出甲醛,用含36.00mL0.1000mol·L-1酸性KMnO4吸收甲醛(不考虑SO2影响,4MnO4-+5HCHO+12H+=4Mn2++5CO2↑+11H2O),再用0.1000mol·L-1的草酸标准溶液滴定酸性KMnO4,再重复实验2次,平均消耗草酸溶液的体积为30.00mL。
(5)滴定终点的判断方法是__;吊白块样品的纯度为__%(保留四位有效数字);若KMnO4标准溶液久置释放出O2而变质,会导致测量结果__(填“偏高”、“偏低”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制取CuCl2的生产流程如下:
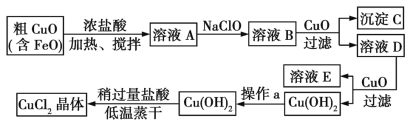
请结合下表数据,回答问题:
物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
溶度积(25 ℃) | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
(1)在溶液A中加入NaClO的目的是_________________。
(2)在溶液B中加入CuO主要涉及的离子反应方程式为________________。
(3)操作a为___________。
(4)在Cu(OH)2中加入盐酸使Cu(OH)2转化为CuCl2,采用稍过量盐酸和低温蒸干的目的是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应2NO2(g)![]() N2 O4(g);△H= -57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
N2 O4(g);△H= -57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是

A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A浅,C深
C.由状态A到状态B,可以用加热的方法
D.A、C两点气体的平均相对分子质量:A>C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯![]() 是有机物合成中的重要试剂,其沸点为
是有机物合成中的重要试剂,其沸点为![]() ,易水解。已知:
,易水解。已知:![]() 微溶于水,能溶于硝酸,
微溶于水,能溶于硝酸,![]() ,某学习小组在实验室用
,某学习小组在实验室用![]() 和NO制备ClNO并测定其纯度,相关实验装置如图所示。
和NO制备ClNO并测定其纯度,相关实验装置如图所示。
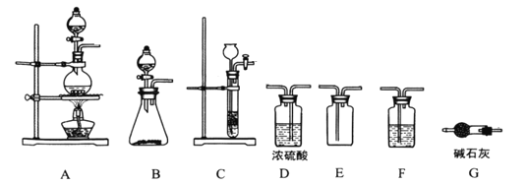
⑴制备![]() 的发生装置可以选用_______(填字母代号)装置,发生反应的离子方程式为___________。
的发生装置可以选用_______(填字母代号)装置,发生反应的离子方程式为___________。
⑵欲收集一瓶干燥的氯气,选择合适的装置,其连接顺序为![]() ________________(填字母代号)。
________________(填字母代号)。
⑶实验室可用图示装置制备亚硝酰氯,检验装置气密性并装入药品,打开![]() ,然后再打开
,然后再打开![]() ,通入一段时间气体,其目的是____________,然后进行其他操作,当Z中有一定量液体生成时,停止实验。
,通入一段时间气体,其目的是____________,然后进行其他操作,当Z中有一定量液体生成时,停止实验。
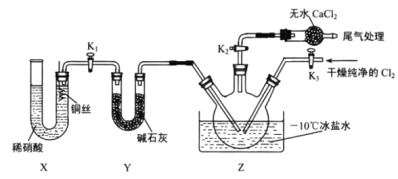
⑷已知:ClNO水解生成![]() 写出化学反应方程式__________________。
写出化学反应方程式__________________。
①欲设计实验证明![]() 是弱酸,需选择如下_____________试剂开展实验
是弱酸,需选择如下_____________试剂开展实验![]() 填选项
填选项![]() 。
。
A. ![]() 溶液 B.
溶液 B. ![]() 溶液 C. 红色石蕊试纸 D. 蓝色石蕊试纸
溶液 C. 红色石蕊试纸 D. 蓝色石蕊试纸
![]() 已知下列物质在常温下的
已知下列物质在常温下的![]() 如图:
如图:
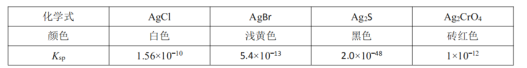
通过以下实验测定ClNO样品的纯度。取Z中所得液体![]() 溶于水,配制成
溶于水,配制成![]() 溶液;取出
溶液;取出![]() 样品溶于锥形瓶中,用
样品溶于锥形瓶中,用![]() 标准溶液滴定至终点,应加入的指示剂是_______________。
标准溶液滴定至终点,应加入的指示剂是_______________。
A.![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
消耗标准溶液的体积为![]() ,滴定终点的现象是 ________________,亚硝酰氯
,滴定终点的现象是 ________________,亚硝酰氯![]() 的质量分数为________。
的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向两只分别盛有50 mL0.100 mol/L盐酸的烧杯中各自匀速滴加50 mL蒸馏水、50 mL0.100 mol/L醋酸铵溶液,装置如图所示(夹持仪器等已略)。
已知:常温下,CH3COONH4溶液pH约为7。
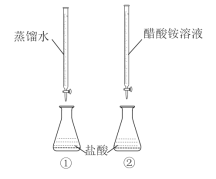
下列说法正确的是( )
A.实验①滴加过程中溶液所有离子浓度都减小
B.实验②滴至pH=2时,溶液中c(Cl-)+c(CH3COO-)+c(OH-)=0.01 mol/L
C.实验②滴加过程中,溶液中均存在c(CH3COO-)<c(NH4+)
D.滴定结束后,①中水的电离程度比②中大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表提供的试剂,用如图所示装置,能制备相应气体的是
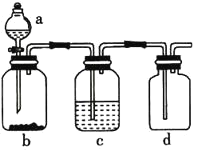
选项 | a中试剂 | b中试剂 | c中试剂 | 实验目的 |
A. | 浓盐酸 | 二氧化锰 | 饱和食盐水 | 制备并收集氯气 |
B. | 稀盐酸 | 石灰石 | 浓硫酸 | 制备并收集二氧化碳 |
C. | 稀硫酸 | 粗锌 | 浓硫酸 | 制备并收集氢气 |
D. | 稀硝酸 | 铜粉 | 浓硫酸 | 制备并收集一氧化氮 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一氧化二氯(Cl2O)是一种常用的氯化剂。常温下,Cl2O是棕黄色、有刺激性气味的气体,熔 点为-120.6°C,沸点为2.0°C,易与水反应生成次氯酸。实验室欲用氯气通入含水8%的碳酸钠固体中 制备并收集少量纯净的Cl2O,请用下列装置设计实验并探究相关物质的性质。
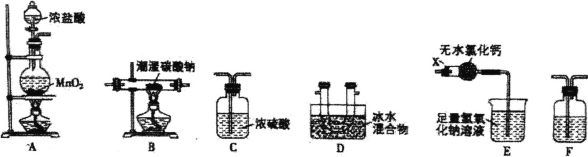
(1)装置E中仪器X的名称为 ______。
(2)装置的连接顺序是A __________(每个装置限用一次)。
(3)装置F中盛装试剂的名称为______,装置E中无水氯化钙的作用是 ________.。
(4)装置B残留固体中除NaCl外还含有一种酸式盐M,写出装置B中发生反应的化学方程式 _______。
(5)证明残留固体中含有M的最简单的实验方案是: _______。
(6)测定残留固体中M的质量分数:取mg样品加适量蒸馏水使之溶解,加入几滴酚酞,用0.1 mol/L 的盐酸标准溶液滴定至溶液由红色变为无色,消耗盐酸V1mL;再向已变无色的溶液中加入几滴甲基橙,继续用该盐酸滴定至溶液由黄色变橙色,又消耗盐酸V2 mL.。
①实验时用到的玻璃仪器有烧杯、胶头滴管、玻璃棒、____。
②求残留固体中M的质量分数__________(用含m、V1和![]() 的代数式表示)。
的代数式表示)。
③若用甲基橙作指示剂滴定结束时,滴定管尖头有气泡,测定结果将____填“偏高"、“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各图的叙述,正确的是( )

A.甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为483.6Kjmol﹣1
B.乙表示恒温恒容条件下发生的可逆反应2NO2![]() N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
C.丙表示A、B两物质的溶解度随温度变化情况,将A、B饱和溶液分别由t1℃升温至t2℃时,溶质的质量分数B>A
D.丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液的pH小于NaB溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com