
【题目】Ⅰ.某化学课外活动小组欲检验茶叶中铁元素,设计了如下实验方案:

请回答:
(1)操作①的名称是_____。
(2)加入6mol·L-1的盐酸时为了加快铁元素的浸出速度,可采取的方法有____、_____。
(3)通过血红色溶液不能说明茶叶中的铁元素一定是+3价的,原因是______。
Ⅱ.乙酸乙酯广泛用于药物、染料、香料等工业,甲乙两同学分别设计了如下装置来制备乙酸乙酯,已知:乙酸乙酯的沸点为77.1℃,CH3CH2OH![]() CH2=CH2↑+H2O
CH2=CH2↑+H2O

(1)甲装置中右边导管未插入溶液中的目的是 ______。
(2)实验结束后分离出乙酸乙酯的操作是 ____,必须用到的玻璃仪器有____(选择)。
A.烧杯 B.容量瓶 C.分液漏斗 D.蒸馏烧瓶
(3)乙装置优于甲装置的理由____________(写两条)。
【答案】过滤 搅拌 适当加热 空气中的O2能将Fe2+氧化为Fe3+ 防倒吸 分液 AC 加热受热均匀、便于控制温度;原料损失较少;不易发生副反应;干燥管下端插入液面下,可以防倒吸同时又可以减少乙酸乙酯的挥发等
【解析】
Ⅰ.(1)操作①得到固体和溶液,既是固液分离,所以是过滤;
(2)加入盐酸后为了提高浸出速率,依据影响反应速率的因素可采取的方法是搅拌,适当加热;
(3)由于茶叶灼烧,空气中的O2能将Fe2+氧化为Fe3+,故加入KSN溶液后变成血红色,不能说明茶叶中的铁元素一定是+3价的。
Ⅱ.(1)反应为可逆反应,挥发出来的有乙酸,乙醇,乙醇极易溶于水,乙酸与碳酸钠溶液反应,故导管未插入溶液中的目的是防倒吸;
(2)乙酸乙酯不溶于水,液体与液体分层,分离的操作是分液,分液用到的玻璃仪器有烧杯,分液漏斗,故AC正确;


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
【题目】将镉(Cd)浸在氯化钴(CoCl2)溶液中,发生反应的离子方程式为Co2+(aq)+Cd(s)===Co(s)+Cd2+(aq)(aq表示溶液),如将该反应设计为如图的原电池,则下列说法一定错误的是( )
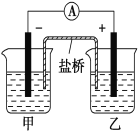
A. Cd作负极,Co作正极
B. 原电池工作时,电子从负极沿导线流向正极
C. 甲池中盛放的是CdCl2溶液,乙池中盛放的是CoCl2溶液
D. 盐桥中装有含氯化钾的琼脂,其作用是传递电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用绿矾(FeSO4·7H2O)为原料制备补血剂甘氨酸亚铁[(H2NCH2COO)2Fe],有关物质性质如下:
甘氨酸(H2NCH2COOH) | 柠檬酸 | 甘氨酸亚铁 |
易溶于水,微溶于乙醇,两性化合物 | 易溶于水和乙醇,有酸性和还原性 | 易溶于水,难溶于乙醇 |
实验过程:
I.配制含0.10molFeSO4的绿矾溶液。
II.制备FeCO3:向配制好的绿矾溶液中,缓慢加入200mL1.1mol/LNH4HCO3溶液,边加边搅拌,反应结束后过滤并洗涤沉淀。
III.制备(H2NCH2COO)2Fe:实验装置如下图(夹持和加热仪器已省略),将实验II得到的沉淀和含0.20mol甘氨酸的水溶液混合后加入C中,然后利用A中反应产生的气体将C中空气排净,接着滴入柠檬酸溶液并加热。反应结束后过滤,滤液经蒸发结晶、过滤、洗涤、干燥得到产品。
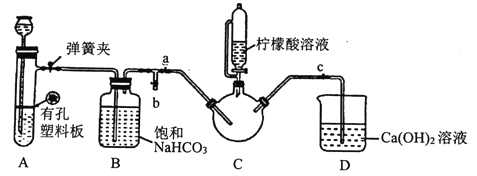
回答下列问题:
(1)实验I中:实验室配制绿矾溶液时,为防止FeSO4被氧化变质,应加入的试剂为____(写化学式)。
(2)实验II中:生成沉淀的离子方程式为________________。
(3)实验III中:
①检查装置A的气密性的方法是_________。
②装置A中所盛放的药品是_______ (填序号)。
a.Na2CO3和稀H2SO4 b.CaCO3和稀H2SO4 c.CaCO3和稀盐酸
③确认c中空气排尽的实验现象是______________。
④加入柠檬酸溶液一方面可调节溶液的pH促进FeCO3溶解,另一个作用是_______。
⑤洗涤实验III中得到的沉淀,所选用的最佳洗涤试剂是___(填序号)。
a.热水 b.乙醇溶液 c.柠檬酸溶液
⑥若产品的质量为17.34g,则产率为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合题图10 的是
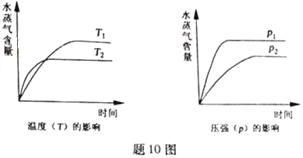
A. CO2(g)+2NH3(g)![]() CO(NH2)2(s)+H2O(g);△H<0
CO(NH2)2(s)+H2O(g);△H<0
B. CO2(g)+H2(g)![]() CO(g)+H2O(g);△H>0
CO(g)+H2O(g);△H>0
C. CH3CH2OH (g)![]() CH2=CH2(g)+H2O(g);△H>0
CH2=CH2(g)+H2O(g);△H>0
D. 2C6H5CH2CH3(g)+O2(g)![]() 2 C6H5CH=CH2(g)+2H2O(g);△H<0
2 C6H5CH=CH2(g)+2H2O(g);△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得到的结论正确的是
选项 | 验操作和现象 | 实验结论 |
A | 将FeSO4高温灼烧,产生的气体通入盐酸酸化的BaCl2溶液中,产生白色沉淀 | 气体中含有SO3(g) |
B | 向(NH4)2Fe(SO4)2溶液中,滴入新制氯水,后再滴入KSCN溶液,溶液变红 | 原(NH4)2Fe(SO4)2部分或完全被氧化 |
C | 向两支均盛有2mLKI3溶液的试管中分别滴入淀粉溶液和硝酸酸化的AgNO3溶液,前者溶液变蓝色,后者有黄色沉淀 | 原KI3溶液中存在I3- |
D | 向3mL苯中加入1mL液溴,然后加入少量FeBr3充分反应后,产物倒入水中,烧杯底部有褐色油状液体 | 溴苯呈褐色,不溶于水,密度比水大 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:
①N2(g)+O2(g)===2NO(g) ΔH1=+180 kJ·mol-1
②N2(g)+3H2(g) ![]() 2NH3(g) ΔH2=-92.4 kJ·mol-1
2NH3(g) ΔH2=-92.4 kJ·mol-1
③2H2(g)+O2(g)===2H2O(g) ΔH3=-483.6 kJ·mol-1
下列说法正确的是

A.反应②中的能量变化如图所示,则ΔH2=E1-E3
B.H2的燃烧热为241.8 kJ·mol-1
C.氨的催化氧化反应为4NH3(g)+5O2(g)===4NO(g)+6H2O(g) ΔH=+906 kJ·mol-1
D.由反应②知在温度一定的条件下,在一恒容密闭容器中通入1 mol N2和3 mol H2,反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2反应后放出的热量为Q2 kJ,则184.8>Q2>2Q1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.有下列各组物质;
A、O2和O3(臭氧) B、12C和13C C、CH3CH2CH2CH3和CH3CH(CH3)2 D、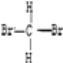 和
和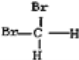
E、葡萄糖和果糖 F、淀粉和纤维素 G、液氯和氯气
(1)______组两物质互为同位素
(2)______组两物质互为同素异形体
(3)______组两组物质互为同分异构体
(4)______组中的物质是同一物质
II、现有下列5种有机物A.苯 B.乙烯 C.乙烷 D.乙醇 E.乙酸。(填代号)
(1)能与H2发生加成反应的有______________。
(2)能与Na反应的有______________________。
(3)能与NaOH溶液反应的有________________。
(4)常温下能与溴水发生化学反应的有________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】孔雀石的主要成分是Cu2(OH)2CO3(含Fe2O3、FeCO3、Al2O3、SiO2杂质),工业上用孔雀石制备硫酸铜的第一步需用过量的硫酸溶解并过滤。常温下,分别取滤液并向其中加入指定物质,反应后的溶液中大量存在的离子组正确的是
A. 加入过量氨水:Fe3+、NH4+、SO42-、OH-
B. 加入过量NaClO溶液:Fe2+、Na+、ClO-、SO42-
C. 加入过量NaOH溶液:Na+、AlO2-、SO42-、OH-
D. 加入过量NaHCO3溶液:Na+、Al3+、SO42-、HCO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com