


 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:
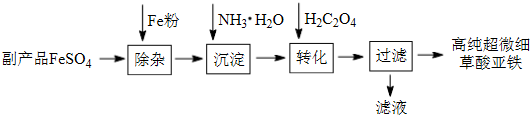
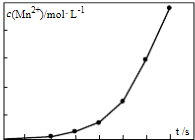
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
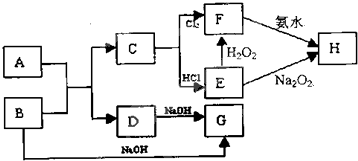
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1H2和2H2互为同位素,性质相似 |
| B、元素的性质随着原子序数的递增呈周期性变化 |
| C、化学反应遵循质量守恒定律相能量守恒定律 |
| D、溶液、浊液、胶体的本质区别是分散质微粒大小不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳和水反应吸收热量131.3 kJ |
| B、1 mol C(s)和1 mol H2O(g)反应生成一氧化碳和氢气,并吸收131.3 kJ的热量 |
| C、1 mol C跟1 mol H2O反应吸收131.3 kJ的热量 |
| D、固体碳和气态水各1 mol反应,放出131.3 kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③ | B、③④⑤ | C、②④ | D、③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com