
【题目】标准状况下,6.72LHCl气体溶于50mL水再配成250mL溶液,
(1)求溶质的物质的量_________
(2)求所得盐酸的物质的量浓度____________?
(3)若将此溶液再稀释成1.5 L溶液,求稀释后盐酸的物质的量浓度______________?
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.取少量卤代烃加NaOH水溶液共热,冷却,再加![]() 溶液可检验卤素原子
溶液可检验卤素原子
B.检测NaClO、![]() 等具有强氧化性物质溶液的pH时,最好选用pH试纸
等具有强氧化性物质溶液的pH时,最好选用pH试纸
C.将铂丝放在稀硫酸中洗涤并灼烧后,再蘸取待检物进行焰色反应
D.若皮肤不慎沾上少量碱液,应先用大量水冲洗,再用2%醋酸溶液或饱和硼酸溶液洗,最后用水冲洗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究二元化合物X的组成和性质,某研究小组设计并完成了如下实验(步骤中所加试剂均过量,部分产物已略去)。
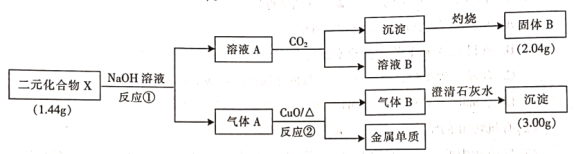
请回答下列问题:
(1)写出X中含有的元素________(用元素符号表示)。
(2)写出反应①的离子方程式___________。
(3)写出反应②的化学方程式___________。
(4)设计实验检验溶液B中所含溶质的阴离子:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种化合物 ,均含有某种常见金属元素,它们的转化关系如图所示,其中A为澄清溶液,C为难溶的白色固体,E则易溶于水,若取A溶液灼烧,焰色反应为紫色(透过蓝色钴玻璃观察)。

请回答下列问题:
(1)写出化学式:B____________,D___________。
(2)五种化合物中难溶于水的是___________________(填化学式)。
(3)写出下列反应的离子方程式:
A→B:_________________________________________________。
B→E:_________________________________________________。
C→E:_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组的同学设计了如图所示的装置,完成下列问题:
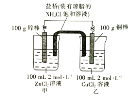
(1)反应过程中,______棒质量增加。
(2)总反应的离子方程式为_____。
(3)反应中,当其中一个电极质量变为102g时,另一电极质量______________(填大于、小于或等于)98g。
(4)反应过程中,盐桥中的________ 离子进入甲杯。
(5)当外电路中转移0.2mol电子时,乙烧杯中浓度最大的阳离子是_________,其物质的量浓度为_______________。(假设溶液体积不变)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】兴趣小组探究实验室中制备Cl2的过程,为证明过程中有水蒸气和HCl挥发出来,同时证明Cl2的某些性质,甲同学设计了如图所示的实验装置,按要求回答问题:

(1)若用浓盐酸与足量的MnO2反应制Cl2。MnO2+4HCl(浓)△MnCl2+Cl2↑+2H2O。
①用双线桥表示该反应的电子转移___。
②___作氧化剂 ,___作还原产物。
(2)①装置B中盛放的试剂名称为___,作用是___。
②装置D和E中出现的不同现象说明的问题是___。
③写出装置G中发生反应的离子方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是一种常见的一种金属,F是一种红褐色的沉淀。试根据图中转化关系,回答下列问题。
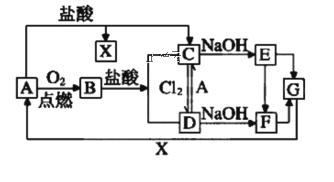
(1)写出A、B、D、E的化学式:A___、B___、D___、E___。
(2)检验D中阳离子的方法:___。
(3)保存C溶液时为什么加固体A___。
(4)写出下列转化的离子方程式
①C→E___。
②A→C___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是硫酸试剂瓶标签上的内容:

(1)某化学兴趣小组进行硫酸性质的实验探究时,需要490mL0.92mol·L-1的稀硫酸,现要配制该浓度的溶液所需的玻璃仪器除量筒、烧杯、玻璃棒、胶头滴管外,还需要__(填仪器名称);需要量取98%浓硫酸__mL进行配制;
(2)配制溶液时有如下操作:a.稀释溶解b.摇匀c.洗涤d.冷却e.量取f.将溶液移至容量瓶g.定容,实验操作顺序正确的是(_____)
A.e→a→f→d→c→f→g→b B.e→a→d→f→c→f→g→b
C.e→a→f→d→c→f→b→g D.e→a→d→f→c→f→b→g
(3)在配制0.92mol·L-1稀硫酸的过程中,下列情况会引起配制所得的硫酸溶液物质的量浓度偏低的是__;
A.未经冷却趁热将溶液注入容量瓶中 B.量取浓硫酸时仰视读数
C.定容时俯视观察液面 D.未洗涤烧杯和玻璃棒
(4)为中和100mL2.3mol·L-1KOH溶液使其恰好完全反应,需要加入__mL0.92mol·L-1稀硫酸。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有效去除废水中的H2SiF6、F-,改善水质是环境部门的重要研究课题。
(1)AlF3是有机合成中常用催化剂,利用废水中的H2SiF6可转变制得,相关的热化学方程式如下:
3H2SiF6(aq)+2Al(OH)3(s)=Al2(SiF6)3(aq)+6H2O(l);ΔH=akJ·mol-1
Al2(SiF6)3(aq)+6H2O(l)=2AlF3(aq)+3SiO2(s)+12HF(aq);ΔH=bkJ·mol-1
3HF(aq)+Al(OH)3(s)=AlF3(aq)+3H2O(l);ΔH=ckJ·mol-1
则反应H2SiF6(aq)+2Al(OH)3(s)=2AlF3(aq)+SiO2(s)+4H2O(l)的ΔH=__kJ·mol-1。
(2)废水的酸碱度及废水中的Fe3+对F-浓度的测定都会产生一定的影响。
①测定时,通常控制废水的pH在5~6之间。pH过小所测F-浓度偏低,其原因是__。
②Fe3+与柠檬酸根(C6F5O73-)、F-反应可表示为Fe3++nC6H5O73-![]() Fe(C6H5O7)n(3n-3)-、Fe3++nF-
Fe(C6H5O7)n(3n-3)-、Fe3++nF-![]() FeFn(3-n)。向含有Fe3+的含氟废水中加入柠檬酸钠(C6H5O7Na3)可消除Fe3+对F-测定的干扰,其原因是__。
FeFn(3-n)。向含有Fe3+的含氟废水中加入柠檬酸钠(C6H5O7Na3)可消除Fe3+对F-测定的干扰,其原因是__。
(3)利用聚苯胺可吸附去除水中F-。用惰性电极电解苯胺(![]() )和盐酸的混合液可在阳极获得聚苯胺薄膜,变化过程如图:
)和盐酸的混合液可在阳极获得聚苯胺薄膜,变化过程如图:
![]()
写出阳极生成二聚体的电极反应方程式:___。
(4)利用MgCO3、Ca(OH)2和CaCO3等可沉淀去除废水中F-。
①以MgCl2溶液、尿素[CO(NH2)2]为原料可制得MgCO3,写出该反应的化学方程式:__。
②取三份相同的含F-的酸性废水,分别加入足量的MgCO3、Ca(OH)2和CaCO3。相同时间后溶液的pH及F-残留量如图1所示。实际废水处理过程中常选用MgCO3的理由是:__。
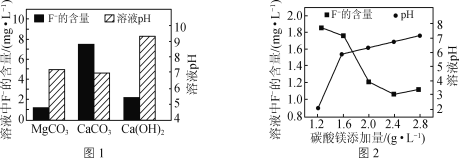
③改变碳酸镁添加量,处理后废水中F-含量及溶液pH的变化如图2所示。添加量超过2.4g·L-1后,F-含量略有升高的原因是___。{Ksp(MgF2)=7.4×10-11,Ksp[Mg(OH)2]=5.6×10-12}
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com