
【题目】下列条件一定能使反应速率加快的是( )
①增加反应物物质的量 ②升高温度 ③缩小反应容器的体积 ④加入生成物 ⑤加入MnO2
A.①②③B.③C.②D.②③
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:
【题目】在一个密闭容器中,中间有一个可自由滑动的隔板,将容器分成两部分。当左边充入1molN2,右边充入8gCO和CO2的混合气体时,隔板处于如下图所示位置,V甲:V乙=4:1(两侧温度、压强均相同)。则混合气体中CO和CO2的物质的量比为( )

A. 1:1 B. 1:3 C. 3:1 D. 2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
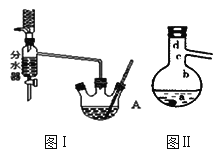
【题目】乙酸正丁酯是医药合成的重要中间体,某同学在实验室中用乙酸和正丁醇来制取,实验操作如下:
Ⅰ.将混合液(18.5 mL正丁醇和13.4 mL过量乙酸,0.4 mL浓硫酸)置于仪器A中并放入适量沸石(见图I,沸石及加热装置等略去),然后加热回流约20分钟。
Ⅱ.将反应后的溶液进行如下处理:①用水洗涤,②用试剂X干燥,③用10% Na2CO3溶液洗涤。
Ⅲ.将所得到的乙酸正丁酯粗品转入蒸馏烧瓶中进行蒸馏,最后得到17.1 g乙酸正丁酯。
部分实验数据如下表所示:
化合物 | 相对分子质量 | 密度/(g·mL-1) | 沸点/℃ | 溶解度(g)/(100 g水) |
正丁醇 | 74 | 0.80 | 118.0 | 9 |
乙酸 | 60 | 1.045 | 118.1 | 互溶 |
乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
(1)使用分水器(实验中可分离出水)能提高酯的产率,其原因是_______________.
(2)步骤Ⅱ中的操作顺序为____________(填序号),试剂X不能选用下列物质中的______________(填字母序号)。
a.无水硫酸镁 b.新制生石灰 c.无水硫酸钠
(3)步骤Ⅲ(部分装置如图Ⅱ所示)。
①当仪器连接好后,a.向相应的冷凝管中通冷凝水;b.加热蒸馏烧瓶,先后顺序是___________。(填“先a后b”或“先b后a”)
②温度计水银球所处的位置不同,会影响馏出物的组成,当温度计水银球分别位于图Ⅱ中的________(填“a”“b”“c”或“d”)点时会导致收集到的产品中混有较多的低沸点杂质。
(4)该实验乙酸正丁酯的产率是_____________。(计算结果保留2位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计用下图的装置制备少量的AlCl3(易水解)。下列说法错误的是( )
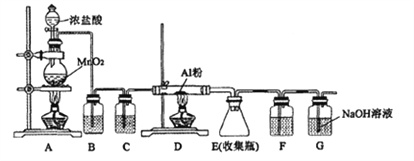
A. B装置中所装试剂为饱和的NaCl溶液,其作用是除去氯气中的HCl
B. 装置C和F中的试剂均为浓硫酸,其作用是防止水蒸气进人E中
C. 用50mL12mol/L的盐酸与足量的MnO2反应,所得氯气可以制取26.7gAlCl3
D. 实验过程中应先点燃A处的酒精灯,待装置中充满黄绿色气体时再点燃D处的酒精灯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在短周期元素中,原子最外电子层只有1个或2个电子的元素是( )
A.一定是金属元素
B.可能是稀有气体元素
C.一定不是非金属元素
D.原子容易失去电子的元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知MnO2为黑色难溶于水的固体,实验室制取氧气的反应为2KClO3![]() 2KCl+3O2↑,反应后从剩余固体中回收二氧化锰的操作顺序正确的是( )
2KCl+3O2↑,反应后从剩余固体中回收二氧化锰的操作顺序正确的是( )
A. 溶解、过滤、蒸发、洗涤 B. 溶解、过滤、洗涤、加热
C. 溶解、蒸发、洗涤、过滤 D. 溶解、洗涤、过滤、加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为实验室某浓盐酸试剂瓶上标签的有关内容。取该盐酸10mL,加蒸馏水稀释至250mL,向其中加入mg锌粉恰好完全反应。
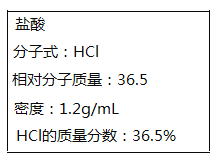
(1)写出锌粉与盐酸反应的离子方程式______________。
(2)求原浓盐酸的物质的量浓度c=____________。
(3)计算出m=___________。
(4)反应中生成的H2可以和标准状况下______mL的O2恰好完全反应。
(5)向反应后的溶液中加入0.6mol/L的AgNO3溶液至不再产生沉淀,共消耗VmL AgNO3溶液,则V的值是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com