
【题目】在一个密闭容器中,中间有一个可自由滑动的隔板,将容器分成两部分。当左边充入1molN2,右边充入8gCO和CO2的混合气体时,隔板处于如下图所示位置,V甲:V乙=4:1(两侧温度、压强均相同)。则混合气体中CO和CO2的物质的量比为( )

A. 1:1 B. 1:3 C. 3:1 D. 2:1
 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】我国盛产黄铜矿(主要含CuFeS2及少量Fe2O3、SiO2),以黄铜矿为原料生产碱式氯化铜的工业流程如下。
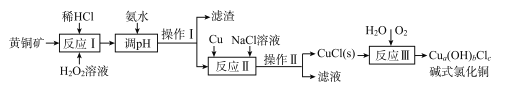
已知:I.a、b、c均为整数
II.![]()
(1)CuFeS2中S的化合价为____。
(2)实验测得反应I中有SO42-生成,该反应中氧化剂与还原剂的物质的量之比为___ ;H2O2优于HNO3的原因是____。
(3)在调节pH时,为稳定浸出液的pH,需要用NH3·H2O- NH4Cl为缓冲溶液。已知 25℃时,向0. 02 mol/L的氨水中缓慢加入等浓度的NH4 Cl溶液,该过程中![]() _____(填“变大”、“变小”或“不变”);若最后所得溶液呈中性,则该体系中离子浓度的大小顺序是____。
_____(填“变大”、“变小”或“不变”);若最后所得溶液呈中性,则该体系中离子浓度的大小顺序是____。
(4)操作I和操作Ⅱ与生活中的下列操作____具有相似的化学原理。
A.用淘米筛沥水 B.泡茶 C.海水晒盐 D.用漏斗分装液体 E.煎药
(5)反应Ⅱ中NaCl浓度过大,碱式氯化铜产率较低,其原因是____。
(6)为测定制得的碱式氯化铜的组成,某实验小组进行下列实验:称取一定量的碱式氯化铜,用少量稀HNCl溶解后配成100. 00 mL溶液A;取25. 00 mL溶液A,加入足量AgNO。溶液,得到AgCl(M一143.5g/mol)固体1.435 g;另取25. 00 ml.溶液A,用浓度为0.40 mol/L的Na2H2Y标准溶液滴定Cu2+(Cu2++H2Y2-=CuY2-+2H+),终点时,消耗标液50. 00 mL。则该碱式氯化铜的化学式为____;反应Ⅲ的化学反应方程式为____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.离子键就是使阴、阳离子通过共用电子对而形成的
B.只有活泼金属与活泼非金属之间才能形成离子键
C.离子化合物受热熔化时可以导电
D.离子化合物溶解时,离子键不被破坏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组根据镁与CO2的反应设计实验探究镁与NO2的反应。
甲同学推测产物是MgO和N2;
乙同学推测产物除了MgO和N2外,固体中还可能含有Y。
该小组同学设计了以下装置探究镁与NO2反应的固体产物,并测定其组成。

(1)实验开始时,先关闭止水夹后打开弹簧夹,再打开分液漏斗活塞,当硬质玻璃管充满红综色气体后,打开止水夹,关闭弹簧夹,最后点燃酒精灯。这样做的目的是___________________________________________________________
(2)装置B中的试剂可以选用________
A、浓硫酸 B、无水氯化钙 C、五氧化二磷 D、碱石灰
(3)装置C中盛装氢氧化钠溶液的作用是:___________________________________
(4)为保证生成气体体积的准确性,读取量筒刻度时应注意的问题是①气体恢复至室温再读数;②_______________________________;③______________________________。
(5)实验结束后,同学们将固体产物取出与水反应,发现有刺激性气味的气体产生,该气体能使湿润的石蕊试纸变蓝。说明乙组同学推测正确,请写出Y与水反应的化学方程式__________________________________
(6)若初始加入镁粉质量为3.6 g,在足量的NO2中充分反应后 ,收集到N2体积为448mL (标准状况),则产物中MgO的质量是_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚硅酸铁是目前无机高分子絮凝剂研究的热点,一种用钢管厂的废铁渣(主要成分Fe3O4,少量C及SiO2)为原料制备的流程如下:
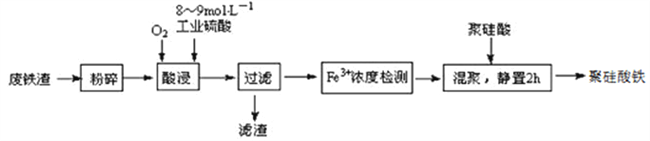
已知:在一定温度下酸浸时Fe3+在pH=2开始沉淀,pH=3.7沉淀完全
(1)废铁渣进行“粉碎”的目的是___________________________________________________。
(2)“酸浸”需适宜的酸浓度、液固比、酸浸温度、氧流量等,其中酸浸温度对铁浸取率的影响如下表所示:
温度℃ | 40 | 60 | 80 | 100 | 120 |
铁浸取率 | 50 | 62 | 80 | 95 | 85 |
①请写出酸浸过程中Fe3O4发生的离子反应方程式__________________________________。
②硫酸酸浸时应控制溶液的pH____________,其原因是_________________________________。
③当酸浸温度超过100℃时,铁浸取率反而减小,其原因是___________________。
(3)上述过滤步骤的滤液的主要成分为____________(填化学式)。
(4)Fe3+浓度定量检则,是先用SnCl2将Fe3+还原为Fe2+;在酸性条件下,再用K2Cr2O7标准溶液滴定Fe2+(Cr2O72-被还原为Cr3+),该滴定反应的离子方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列条件一定能使反应速率加快的是( )
①增加反应物物质的量 ②升高温度 ③缩小反应容器的体积 ④加入生成物 ⑤加入MnO2
A.①②③B.③C.②D.②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com