
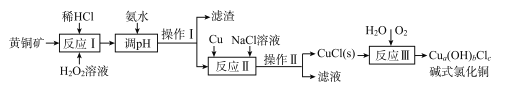
【题目】我国盛产黄铜矿(主要含CuFeS2及少量Fe2O3、SiO2),以黄铜矿为原料生产碱式氯化铜的工业流程如下。
已知:I.a、b、c均为整数
II.![]()
(1)CuFeS2中S的化合价为____。
(2)实验测得反应I中有SO42-生成,该反应中氧化剂与还原剂的物质的量之比为___ ;H2O2优于HNO3的原因是____。
(3)在调节pH时,为稳定浸出液的pH,需要用NH3·H2O- NH4Cl为缓冲溶液。已知 25℃时,向0. 02 mol/L的氨水中缓慢加入等浓度的NH4 Cl溶液,该过程中![]() _____(填“变大”、“变小”或“不变”);若最后所得溶液呈中性,则该体系中离子浓度的大小顺序是____。
_____(填“变大”、“变小”或“不变”);若最后所得溶液呈中性,则该体系中离子浓度的大小顺序是____。
(4)操作I和操作Ⅱ与生活中的下列操作____具有相似的化学原理。
A.用淘米筛沥水 B.泡茶 C.海水晒盐 D.用漏斗分装液体 E.煎药
(5)反应Ⅱ中NaCl浓度过大,碱式氯化铜产率较低,其原因是____。
(6)为测定制得的碱式氯化铜的组成,某实验小组进行下列实验:称取一定量的碱式氯化铜,用少量稀HNCl溶解后配成100. 00 mL溶液A;取25. 00 mL溶液A,加入足量AgNO。溶液,得到AgCl(M一143.5g/mol)固体1.435 g;另取25. 00 ml.溶液A,用浓度为0.40 mol/L的Na2H2Y标准溶液滴定Cu2+(Cu2++H2Y2-=CuY2-+2H+),终点时,消耗标液50. 00 mL。则该碱式氯化铜的化学式为____;反应Ⅲ的化学反应方程式为____________
【答案】 -2 17:2 HNO3的还原产物污染环境,或双氧水还原产物是水不引入杂质 变大 c(NH4+)=c(Cl-)>c(OH-)=c(H+) A NaCl过多CuCl会生成CuCl22-溶解损失 Cu2(OH)3Cl 4CuCl+4H2O+O2=2Cu2(OH)3Cl+2HCl
【解析】(1) CuFeS2中S的化合价为-2价;(2)实验测得反应I中有SO42-生成,2CuFeS2+17H2O2+2H+=2Cu2++2Fe3++4SO42-+18H2O,该反应中氧化剂与还原剂的物质的量之比为 17:2 ;H2O2优于HNO3的原因是HNO3的还原产物污染环境,或双氧水还原产物是水不引入杂质;(3)已知 25℃时,向0. 02 mol/L的氨水中缓慢加入等浓度的NH4 Cl溶液,氨根离子浓度变大,酸性增强,氢氧根离子浓度变小,该过程中![]() 变大;若最后所得溶液呈中性,根据电荷守恒:c(NH4+)+c(H+)=c(Cl-)+c(OH-),则该体系中离子浓度的大小顺序是c(NH4+)=c(Cl-)>c(OH-)=c(H+);(4)操作I和操作Ⅱ为过滤,与生活中的下列操作用淘米筛沥水具有相似的化学原理,故选A。(5)反应Ⅱ中NaCl浓度过大,碱式氯化铜产率较低,其原因是NaCl过多CuCl会生成CuCl22-溶解损失;(6)n(Cl-)=n(AgCl)×100.00mL/25.00mL=1.435 g/143.5g·mol-1×100.00mL/25.00mL=4.000×10-2mol,n(Cu2+)=n(EDTA)×100.00mL/25.00mL=0.4000 mol·L-1×50.00 mL×10-3 L·mL-1×100.00mL/25.00mL=8.000×10-2 mol,n(OH-)=2n(Cu2+)-n(Cl-)=2×8.000×10-2mol-4.000×10-2 mol=1.2×10-2 mol,n(Cu2+):n(OH-):n(Cl-):n(H2O)=2:3:1:即化学式为Cu2(OH)3Cl;反应Ⅲ的化学反应方程式为4CuCl+4H2O+O2=2Cu2(OH)3Cl+2HCl。
变大;若最后所得溶液呈中性,根据电荷守恒:c(NH4+)+c(H+)=c(Cl-)+c(OH-),则该体系中离子浓度的大小顺序是c(NH4+)=c(Cl-)>c(OH-)=c(H+);(4)操作I和操作Ⅱ为过滤,与生活中的下列操作用淘米筛沥水具有相似的化学原理,故选A。(5)反应Ⅱ中NaCl浓度过大,碱式氯化铜产率较低,其原因是NaCl过多CuCl会生成CuCl22-溶解损失;(6)n(Cl-)=n(AgCl)×100.00mL/25.00mL=1.435 g/143.5g·mol-1×100.00mL/25.00mL=4.000×10-2mol,n(Cu2+)=n(EDTA)×100.00mL/25.00mL=0.4000 mol·L-1×50.00 mL×10-3 L·mL-1×100.00mL/25.00mL=8.000×10-2 mol,n(OH-)=2n(Cu2+)-n(Cl-)=2×8.000×10-2mol-4.000×10-2 mol=1.2×10-2 mol,n(Cu2+):n(OH-):n(Cl-):n(H2O)=2:3:1:即化学式为Cu2(OH)3Cl;反应Ⅲ的化学反应方程式为4CuCl+4H2O+O2=2Cu2(OH)3Cl+2HCl。


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
【题目】某学生用12 mol·L-1的浓盐酸配制0.10 mol·L-1的稀盐酸500 mL。可供选择的仪器有:①玻璃棒、②烧瓶、③烧杯、④胶头滴管、⑤量筒、⑥500 mL容量瓶
回答下列问题:
(1)计算量取浓盐酸的体积为____ mL
(2)配制过程中,一定用不到的仪器是________(填序号)
(3)将浓盐酸加入适量蒸馏水稀释后,全部转移到500 mL容量瓶中,转移过程中玻璃棒的作用是____。转移完毕,用少量蒸馏水洗涤仪器2~3次,并将洗涤液全部转移到容量瓶中。然后缓缓地把蒸馏水直接注入容量瓶,直到液面接近刻度线1-2cm处。改用______滴加蒸馏水,使溶液的凹液面的最低处与刻度线相切。振荡、摇匀后,装瓶、贴签。
(4)在配制过程中,其他操作都准确,下列操作对所配溶液浓度的影响(填“偏高”、“偏低”或“无影响”)
①定容时,加蒸馏水超过刻度线,又用胶头滴管吸出重新加水至刻度线_______
②转移前,容量瓶中含有少量蒸馏水_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在3个体积均为1.0 L的恒容密闭容器中反应2H2(g)+CO(g)![]() CH3OH(g) 达到平衡。下列说法正确的是
CH3OH(g) 达到平衡。下列说法正确的是

A. 该反应的正反应放热
B. 达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大
C. 达到平衡时,容器Ⅱ中c(H2)大于容器Ⅲ中c(H2)的两倍
D. 达到平衡时,容器Ⅲ中的正反应速率比容器Ⅰ中的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过传感器可以监测空气中甲醛的含量。一种燃料电池型甲醛气体传感器的原理如图所示,下列说法错误的是

A. a为电池的正极,发生还原反应
B. b极的电极反应为HCHO+H2O-4e-==CO2+4H+
C. 传感器工作过程中,电解质溶液中硫酸的浓度减小
D. 当电路中转移2×10-4 mol电子时,传感器内参加反应的HCHO为3.0 mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温常压下,在带有相同质量活塞的容积相等的甲、乙两容器里,分别充有二氧化氮和空气,分别进行下列两项实验:
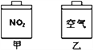
(a)将两容器置于沸水中加热
(b)在活塞上都加2 kg的砝码
已知:N2O4(g)![]() 2NO2(g) △H>0在以上两情况下,甲和乙容器的体积大小,正确的是
2NO2(g) △H>0在以上两情况下,甲和乙容器的体积大小,正确的是
A. (a)甲>乙,(b)甲>乙 B. (a)甲>乙,(b)甲=乙
C. (a)甲<乙,(b)甲>乙 D. (a)甲>乙,(b)甲<乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)人体内的铁元素以Fe2+和Fe3+的形式存在。正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的Fe3+还原成Fe2+,有利于人体吸收。这句话说明维生素C在这一反应中起的作用是__________________。
(2)实验室可以用铜和稀硝酸反应制取NO,反应的化学方程式如下:
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑ +4H2O
①该反应中还原剂为__________
②氧化剂与还原剂之比是__________
③如果反应中转移了0.15mol电子,则产生的气体在标准状况下体积为______________
④用双线桥标出该反应转移电子数目情况_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个密闭容器中,中间有一个可自由滑动的隔板,将容器分成两部分。当左边充入1molN2,右边充入8gCO和CO2的混合气体时,隔板处于如下图所示位置,V甲:V乙=4:1(两侧温度、压强均相同)。则混合气体中CO和CO2的物质的量比为( )

A. 1:1 B. 1:3 C. 3:1 D. 2:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com