
【题目】某学生用12 mol·L-1的浓盐酸配制0.10 mol·L-1的稀盐酸500 mL。可供选择的仪器有:①玻璃棒、②烧瓶、③烧杯、④胶头滴管、⑤量筒、⑥500 mL容量瓶
回答下列问题:
(1)计算量取浓盐酸的体积为____ mL
(2)配制过程中,一定用不到的仪器是________(填序号)
(3)将浓盐酸加入适量蒸馏水稀释后,全部转移到500 mL容量瓶中,转移过程中玻璃棒的作用是____。转移完毕,用少量蒸馏水洗涤仪器2~3次,并将洗涤液全部转移到容量瓶中。然后缓缓地把蒸馏水直接注入容量瓶,直到液面接近刻度线1-2cm处。改用______滴加蒸馏水,使溶液的凹液面的最低处与刻度线相切。振荡、摇匀后,装瓶、贴签。
(4)在配制过程中,其他操作都准确,下列操作对所配溶液浓度的影响(填“偏高”、“偏低”或“无影响”)
①定容时,加蒸馏水超过刻度线,又用胶头滴管吸出重新加水至刻度线_______
②转移前,容量瓶中含有少量蒸馏水_________
【答案】4.2 ② 引流 胶头滴管 偏低 无影响
【解析】
(1)根据![]() 计算所需浓盐酸的体积;(2)用浓溶液配制稀溶液所需要的仪器有:量筒、烧杯、玻璃棒、500mL容量瓶、胶头滴管;(3)转移过程中用玻璃棒将溶液引流注入容量瓶里。为防止定容时加水过量,最后用胶头滴管滴加。(4)根据
计算所需浓盐酸的体积;(2)用浓溶液配制稀溶液所需要的仪器有:量筒、烧杯、玻璃棒、500mL容量瓶、胶头滴管;(3)转移过程中用玻璃棒将溶液引流注入容量瓶里。为防止定容时加水过量,最后用胶头滴管滴加。(4)根据![]() 分析误差。
分析误差。
(1)设量取浓盐酸的体积为v mL,12 mol·L-1×v mL=0.10 mol·L-1×500 mL,解得v=4.2 mL;(2)用浓溶液配制稀溶液所需要的仪器有:量筒、烧杯、玻璃棒、500mL容量瓶、胶头滴管,不需要的是烧瓶,故选②;(3)转移过程中用玻璃棒将溶液引流注入容量瓶里,所以玻璃棒的作用是引流。为防止定容时加水过量,液面接近刻度线1-2cm处时,改用胶头滴管滴加蒸馏水,使溶液的凹液面的最低处与刻度线相切。(4)①定容时,加蒸馏水超过刻度线,又用胶头滴管吸出重新加水至刻度线,溶质物质的量减少,所配溶液浓度偏低;②溶液配制最后需加水定容,转移前容量瓶中含有少量蒸馏水,对所配溶液浓度无影响。


科目:高中化学 来源: 题型:
【题目】25℃时, c mol·L—1CH3COOH 溶液加水稀释, 溶液中 CH3COOH 和 CH3COOˉ二者中各自所占的物质的量分数(α)随溶液 pH 变化的关系如图所示。下列说法不正确的是
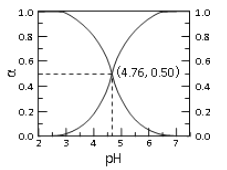
A. 由图可知, 25℃时醋酸的 Ka=10-4.76
B. c mol·L—1CH3COOH 溶液加水稀释中, α(CH3COOH)增大, c(CH3COOˉ)也一定增大
C. 在 pH=4.76 的溶液中通入 HCl, α(CH3COOH)增大,α(CH3COOˉ)减小, α(CH3COOH)+α(CH3COOˉ)=1
D. 对于图像中曲线上任意一点所对应的溶液中,都有 c(CH3COOˉ)+c(OHˉ)=c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质“反应程度”的说法正确的是( )
A.一定条件下,2molSO2与足量O2反应可得到2molSO3
B.含4mol HCl的浓盐酸与足量的MnO2加热反应可制备1mol Cl2
C.10mL 18.0mol/L H2SO4与足量铜加热反应可制备0.09molSO2
D.一定条件下,1mol N2与3mol H2反应可制备1.0mol NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是某化学研究小组探究外界条件对化学反应速率和化学平衡影响的图像,其中图像和实验结论表达均正确的是( )


A. ①是其他条件一定时,反应速率随温度变化的图像,正反应ΔH<0
B. ②是在平衡体系的溶液中溶入少量KCl晶体后化学反应速率随时间变化的图像
C. ③是在有无催化剂存在下建立的平衡过程图像,a是使用催化剂时的曲线
D. ④是一定条件下,向含有一定量A的容器中逐渐加入B时的图像,压强p1>p2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定的四种溶液中加入以下各种离子,能在原溶液中大量共存的是
A. 常温下pH=1 的溶液: K+、HCO3-、Br、Ba2+
B. 滴加酚酞溶液显红色的溶液:Fe3+、NH4+、Cl、NO3-
C. 所含溶质为FeCl3的溶液:K+、SO42-、NO3-、H+
D. 强碱性溶液:Cu2+、Na+、Mg2+、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某河道两旁有甲、乙两厂,它们排放的工业废水中共含K+、Ag+、Fe3+、Cl-、OH-、NO![]() 六种离子。
六种离子。
(1)甲厂的废水含有OH-,则甲厂废水中一定不含_______和________(填离子符号)。
(2)乙厂的废水中一定含有的阴离子是________(填离子符号),加入铁粉后可回收某种金属,写出该反应的离子方程式:__________________________。
(3)另一种设想是将甲厂和乙厂的废水按适当的比例混合,可以使废水中的某些离子转化为沉淀。经过滤后的废水主要含________(写化学式),可用来浇灌农田。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学反应与能量的说法正确的是
A. 中和反应是吸热反应 B. 燃烧属于放热反应
C. 化学键断裂放出能量 D. 反应物总能量与生成物总能量一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国盛产黄铜矿(主要含CuFeS2及少量Fe2O3、SiO2),以黄铜矿为原料生产碱式氯化铜的工业流程如下。
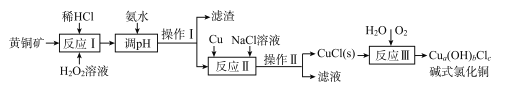
已知:I.a、b、c均为整数
II.![]()
(1)CuFeS2中S的化合价为____。
(2)实验测得反应I中有SO42-生成,该反应中氧化剂与还原剂的物质的量之比为___ ;H2O2优于HNO3的原因是____。
(3)在调节pH时,为稳定浸出液的pH,需要用NH3·H2O- NH4Cl为缓冲溶液。已知 25℃时,向0. 02 mol/L的氨水中缓慢加入等浓度的NH4 Cl溶液,该过程中![]() _____(填“变大”、“变小”或“不变”);若最后所得溶液呈中性,则该体系中离子浓度的大小顺序是____。
_____(填“变大”、“变小”或“不变”);若最后所得溶液呈中性,则该体系中离子浓度的大小顺序是____。
(4)操作I和操作Ⅱ与生活中的下列操作____具有相似的化学原理。
A.用淘米筛沥水 B.泡茶 C.海水晒盐 D.用漏斗分装液体 E.煎药
(5)反应Ⅱ中NaCl浓度过大,碱式氯化铜产率较低,其原因是____。
(6)为测定制得的碱式氯化铜的组成,某实验小组进行下列实验:称取一定量的碱式氯化铜,用少量稀HNCl溶解后配成100. 00 mL溶液A;取25. 00 mL溶液A,加入足量AgNO。溶液,得到AgCl(M一143.5g/mol)固体1.435 g;另取25. 00 ml.溶液A,用浓度为0.40 mol/L的Na2H2Y标准溶液滴定Cu2+(Cu2++H2Y2-=CuY2-+2H+),终点时,消耗标液50. 00 mL。则该碱式氯化铜的化学式为____;反应Ⅲ的化学反应方程式为____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.离子键就是使阴、阳离子通过共用电子对而形成的
B.只有活泼金属与活泼非金属之间才能形成离子键
C.离子化合物受热熔化时可以导电
D.离子化合物溶解时,离子键不被破坏
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com