
【题目】下列过程属于化学变化的是
A. 焰色反应 B. 石油分馏 C. 碘的升华 D. 粮食酿酒
科目:高中化学 来源: 题型:
【题目】科学家最近合成了一种新型分子,它由4个氧原子构成,液化后能量、密度都比普通氧分子高得多。下列说法正确的是
A.摩尔质量是64gB.它是一种新的化合物
C.它是由氧元素组成的一种单质D.1mol该分子中含有2NA个氧分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时, c mol·L—1CH3COOH 溶液加水稀释, 溶液中 CH3COOH 和 CH3COOˉ二者中各自所占的物质的量分数(α)随溶液 pH 变化的关系如图所示。下列说法不正确的是
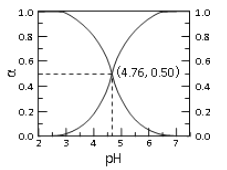
A. 由图可知, 25℃时醋酸的 Ka=10-4.76
B. c mol·L—1CH3COOH 溶液加水稀释中, α(CH3COOH)增大, c(CH3COOˉ)也一定增大
C. 在 pH=4.76 的溶液中通入 HCl, α(CH3COOH)增大,α(CH3COOˉ)减小, α(CH3COOH)+α(CH3COOˉ)=1
D. 对于图像中曲线上任意一点所对应的溶液中,都有 c(CH3COOˉ)+c(OHˉ)=c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe3+、SO42-、Al3+和X四种离子以个数比2:4:1:1大量共存于同一溶液中,X可能是( )
A.Na+B.OH-C.CO32-D.Cl–
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非金属单质A经如图所示的过程转化为含氧酸D,已知D为强酸,请回答下列问题。
![]()
![]()
![]()
![]()
![]()
![]()
![]()
(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体:
①D的化学式是________;
②在工业生产中,B气体的大量排放被雨水吸收后形成了________而污染了环境。
(2)若A在常温下为气体,C是红棕色的气体:
①A、C的化学式分别是:A________;C________。
②D的浓溶液在常温下可与铜反应并生成C气体,请写出该反应的化学方程式_______________________________________________。该反应________(填“属于”或“不属于”)氧化还原反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: A 用于医疗消毒, C 为常用调味品; E 与 B 都能发生银镜反应, E 的相对分子质量比 B 大 12,请回答:
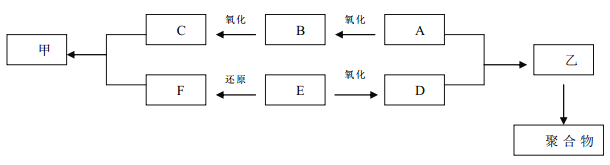
(1)求 E 的结构简式_______;乙生成聚合物的反应类型_______。
(2)C 生成甲的方程式_______。
(3)下列说法不正确的是________。
A. 物质 A 与金属钠反应比水与金属钠反应要剧烈
B. 用蒸馏的方法分离物质 A 与 C 可得到纯净的 A
C. 根据溴水褪色现象,可以证明物质 E 中一定存在碳碳双键
D.新制碱性氢氧化铜悬浊液可鉴别物质 A、 B 和 C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质“反应程度”的说法正确的是( )
A.一定条件下,2molSO2与足量O2反应可得到2molSO3
B.含4mol HCl的浓盐酸与足量的MnO2加热反应可制备1mol Cl2
C.10mL 18.0mol/L H2SO4与足量铜加热反应可制备0.09molSO2
D.一定条件下,1mol N2与3mol H2反应可制备1.0mol NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是某化学研究小组探究外界条件对化学反应速率和化学平衡影响的图像,其中图像和实验结论表达均正确的是( )


A. ①是其他条件一定时,反应速率随温度变化的图像,正反应ΔH<0
B. ②是在平衡体系的溶液中溶入少量KCl晶体后化学反应速率随时间变化的图像
C. ③是在有无催化剂存在下建立的平衡过程图像,a是使用催化剂时的曲线
D. ④是一定条件下,向含有一定量A的容器中逐渐加入B时的图像,压强p1>p2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国盛产黄铜矿(主要含CuFeS2及少量Fe2O3、SiO2),以黄铜矿为原料生产碱式氯化铜的工业流程如下。
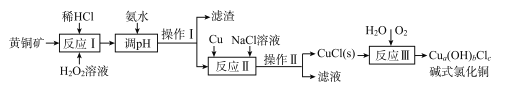
已知:I.a、b、c均为整数
II.![]()
(1)CuFeS2中S的化合价为____。
(2)实验测得反应I中有SO42-生成,该反应中氧化剂与还原剂的物质的量之比为___ ;H2O2优于HNO3的原因是____。
(3)在调节pH时,为稳定浸出液的pH,需要用NH3·H2O- NH4Cl为缓冲溶液。已知 25℃时,向0. 02 mol/L的氨水中缓慢加入等浓度的NH4 Cl溶液,该过程中![]() _____(填“变大”、“变小”或“不变”);若最后所得溶液呈中性,则该体系中离子浓度的大小顺序是____。
_____(填“变大”、“变小”或“不变”);若最后所得溶液呈中性,则该体系中离子浓度的大小顺序是____。
(4)操作I和操作Ⅱ与生活中的下列操作____具有相似的化学原理。
A.用淘米筛沥水 B.泡茶 C.海水晒盐 D.用漏斗分装液体 E.煎药
(5)反应Ⅱ中NaCl浓度过大,碱式氯化铜产率较低,其原因是____。
(6)为测定制得的碱式氯化铜的组成,某实验小组进行下列实验:称取一定量的碱式氯化铜,用少量稀HNCl溶解后配成100. 00 mL溶液A;取25. 00 mL溶液A,加入足量AgNO。溶液,得到AgCl(M一143.5g/mol)固体1.435 g;另取25. 00 ml.溶液A,用浓度为0.40 mol/L的Na2H2Y标准溶液滴定Cu2+(Cu2++H2Y2-=CuY2-+2H+),终点时,消耗标液50. 00 mL。则该碱式氯化铜的化学式为____;反应Ⅲ的化学反应方程式为____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com