
【题目】十九大报告指出:“坚持全民共治、源头防治,持续实施大气污染防治行动,打赢蓝天保卫战!”以NOx为主要成分的雾霾的综合治理是当前重要的研究课题。
Ⅰ.汽车尾气中的NO(g)和CO(g)在一定条件下可发生如下反应:
反应①2NO(g)+ 2CO(g) N2(g) + 2CO2(g) ΔH1。
(1)已知:反应②N2(g)+O2(g) 2NO(g) ΔH2= +180.5 kJ·mol-1,CO的燃烧热为283.0 kJ·mol-1,则ΔH1=____。
(2)在密闭容器中充入5molCO和4molNO,发生上述反应①,图1为平衡时NO的体积分数与温度、压强的关系。
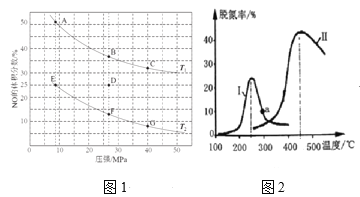
①温度:T1____T2(填“<”或“>”) 。
②若在D点对反应容器升温的同时扩大体积使体系压强减小,重新达到的平衡状态可能是图中A~G点中的____点。
(3)某研究小组探究催化剂对CO、NO转化的影响。将NO和CO以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中NO含量,从而确定尾气脱氮率(脱氮率即NO的转化率),结果如图2所示。若低于200℃,图2中曲线Ⅰ脱氮率随温度升高而变化不大的主要原因为______;a点_____(填“是”或“不是”)对应温度下的平衡脱氮率,说明其理由______。
II.N2O是一种强温室气体,且易形成颗粒性污染物,研究N2O的分解对环境保护有重要意义。
(4)碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步I2(g) 2I(g) (快反应)
第二步I(g)+N2O(g) → N2(g)+IO(g) (慢反应)
第三步IO(g)+N2O(g) → N2(g)+O2(g)+I2(g) (快反应)
实验表明,含碘时N2O分解速率方程v = k·c(N2O)·[c(I2)]0.5(k为速率常数)。下列表述正确的是____。
A.I2浓度与N2O分解速无关 B.第二步对总反应速率起决定作用
C.第二步活化能比第三步小 D.IO为反应的中间产物
【答案】-746.5kJ/mol > A 温度较低时,催化剂的活性偏低 不是 该反应为放热反应,根据线II可知,a点对温度的平衡脱氮率应该更高 BD
【解析】
(1)CO燃烧热的△H1=-283.0kJmol-l,热化学方程式为:①CO(g)+![]() O2(g)=CO2(g) △H1=-283.0kJmol-l,再根据盖斯定律分析计算;
O2(g)=CO2(g) △H1=-283.0kJmol-l,再根据盖斯定律分析计算;
(2)根据(1)的计算结果,结合温度和压强对平衡的影响分析判断;
(3)催化剂在低温下活性不大;根据图像可知a点不是对应温度下的平衡脱氮率;
(4)根据反应历程结合速率方程分析判断。
(1)CO燃烧热的△H1=-283.0kJmol-l,热化学方程式为:①CO(g)+![]() O2(g)=CO2(g) △H1=-283.0kJmol-l,②N2(g)+O2(g)2NO(g)△H2=+180.5kJmol-1,根据盖斯定律,将①×2-②得:2NO(g)+2CO(g)N2(g)+2CO2(g)△H=-746.5kJ/mol,故答案为:-746.5kJ/mol;
O2(g)=CO2(g) △H1=-283.0kJmol-l,②N2(g)+O2(g)2NO(g)△H2=+180.5kJmol-1,根据盖斯定律,将①×2-②得:2NO(g)+2CO(g)N2(g)+2CO2(g)△H=-746.5kJ/mol,故答案为:-746.5kJ/mol;
(2)①根据反应2CO(g)+2NO(g)N2(g)+2CO2(g)△H=-746.5kJmol-1,升高温度,平衡逆向移动,所以NO的体积分数会增大,即T1>T2,故答案为:>;
②若在D点对反应容器升温的同时扩大体积使体系压强减小,则平衡会逆向移动,NO的体积分数增加,重新达到的平衡状态可能是图中A点,故答案为:A。
(3)根据图像可知,温度较低时,催化剂的活性偏低,因此温度低于200℃,曲线Ⅰ脱氮率随温度升高变化不大;a点不是对应温度下的平衡脱氮率,因为该反应为放热反应,根据线II可知,a点对温度的平衡脱氮率应该更高,故答案为:温度较低时,催化剂的活性偏低;不是;该反应为放热反应,根据线II可知,a点对温度的平衡脱氮率应该更高;
(4)A.N2O分解反应中,实验表明,含碘时N2O分解速率方程v=kc(N2O)[c(I2)]0.5(k为速率常数),和碘蒸气有关,故A错误;B.第二步I(g)+N2O(g)→N2(g)+IO(g)(慢反应),在整个反应过程中起到决定性作用,故B正确;C.第二步反应慢说明活化能比第三步大,故C错误;D.第一步I2(g)2I(g)(快反应),第二步I(g)+N2O(g)→N2(g)+IO(g)(慢反应),第三步IO(g)+N2O(g)→N2(g)+O2(g)+H(g)(快反应),过程中IO为反应的中间产物,故D正确;故答案为:BD。


科目:高中化学 来源: 题型:
【题目】已知H2O2、KMnO4、NaClO、K2Cr2O7均具有强氧化性,将溶液中的Cu2+、Fe2+、Fe3+沉淀为氢氧化物,需溶液的pH分别为6.4、6.4、3.7。现有含FeClx杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按图示步骤进行提纯:

请回答下列问题:
(1)本实验最适合的氧化剂X是__________。(选填下面的序号)
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(2)物质Y是__________。
(3)本实验用加碱沉淀的目的是否能达到?__________。原因是__________。
(4)加氧化剂的目的为__________。
(5)最后能不能直接蒸发结晶得到CuCl2·2H2O晶体?________。如何操作?__________。·
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有室温下四种溶液,有关叙述不正确的是
序号 | ① | ② | ③ | ④ |
pH | 11 | 11 | 3 | 3 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
A. ③④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大
B. ②③两溶液等体积混合,所得溶液中c(H+)>c(OH-)
C. 分别加水稀释10倍,四种溶液的pH①>②>④>③
D. V1L④与V2L①溶液混合后,若混合后溶液pH=7,则V1<V2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的前四周期元素,X、Z的周期序数=族序数,由这四种元素组成的单质或化合物存在如图所示的转化关系,其中甲、戊是两常见的金属单质,丁是非金属单质,其余为氧化物且丙为具有磁性的黑色晶体。下列说法正确的是

A. W的原子序数是Z的两倍,金属性强于Z
B. W元素在周期表中的位置是第四周期VIII族
C. 丙属于两性氧化物
D. 等物质的量的甲和戊完全溶于稀硝酸,消耗的HNO3的量一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以柏林绿Fe[Fe(CN)6]为代表的新型可充电钠离子电池,其放电工作原理如图所示。下列说法错误的是

A. 放电时,正极反应为Fe[Fe(CN)6]+2Na++2e-=Na2Fe[Fe(CN)6]
B. 充电时,Mo(钼)箔接电源的负极
C. 充电时,Na+通过交换膜从左室移向右室
D. 外电路中通过0.2mol电子的电量时,负极质量变化为2.4g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
I.(1)AlCl3的水溶液pH______7(填>、=、<=,其原因为______________(用离子方程式表示),将其溶液加热蒸干并灼烧最终得到物质是_____________________(填化学式)。
(2)常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH)=1032,要使c(Cr3+)降至105mol/L,溶液的pH应调至_____________。
(3)物质的量浓度相同的三种溶液:①NH4Cl ②氨水 ③NH4HSO4,c(NH4+)大小顺序正确的是______________。(用序号表示)
(4)常温下两种溶液:a.pH=4 NH4Cl b.pH=4盐酸溶液,其中水电离出C(H+)之比为____________________。
II.室温下,某一元弱酸HA的电离常数K=1.6×10-6。 向20.00 mL 浓度约为0.1 mol·L-1 HA溶液中逐滴加入0.1000 mol·L-1 的标准NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。请回答下列有关问题:

(1)a、b、c、d四点中水的电离程度最大的是________点,滴定过程中宜选用________作指示剂,滴定终点在________(填“c点以上”或“c点以下”)。
(2)滴定过程中部分操作如下,下列各操作使测量结果偏高的是___________(填字母序号)。
A.滴定前碱式滴定管未用标准NaOH溶液润洗
B.用蒸馏水洗净锥形瓶后,立即装入HA溶液后进行滴定
C.滴定过程中,溶液出现变色后,立即停止滴定
D.滴定结束后,仰视液面,读取NaOH溶液体积
(3)若重复三次滴定实验的数据如下表所示,计算滴定所测HA溶液的物质的量浓度为___mol/L。(保留4位有效数字)
实验序号 | NaOH溶液体积/mL | 待测HA溶液体积/mL |
1 | 21.01 | 20.00 |
2 | 20.99 | 20.00 |
3 | 21.60 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸铵是一种常用的化肥,其工业生产流程如图,请回答下列问题。

(1)写出反应容器B中发生反应的化学方程式:___。
(2)吸收塔C中通入空气的目的是___(用化学方程式解释);C、D两个反应容器中发生的反应,属于氧化还原反应的是___ (填反应容器代号)。
(3)浓硝酸一般保存在棕色试剂瓶里,并放置在阴凉处,用化学方程式解释原因:___。
(4)碳与浓硝酸反应的化学方程式是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种短周期主族元素,原子序数依次增大,A原子的最外层上有4个电子;C的阴离子和D的阳离子具有相同的电子层结构,两种元素的单质反应,可生成一种淡黄色的固体F,E的L层电子数等于K、M层电子数之和。
(1)B位于第__________周期第__________族,C常见单质的电子式为________。
(2)B、C、D、E元素的简单离子半径由小到大的顺序为__________________________(用离子符号表示)。
(3)C的一种氢化物分子中含有18个电子,其结构式为____________。
(4)已知A、E两种元素形成的化合物H,H结构与干冰相似,属于______________(填“离子”或“共价”)化合物。7.6 g的H中含有的共用电子对数目为________。
(5)E的最高价氧化物对应的水化物的浓溶液和A的单质加热发生反应的化学方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸是植物(特别是草本植物)常具有的成分,具有广泛的用途。草酸晶体(H2C2O42H2O)无色,熔点为101℃,易溶于水,受热易脱水、升华,170℃以上分解。常温下它的电离常数 K1=5.4×10-2,K2=5.4×10-5。回答下列问题:
(1)拟用下列装置分解草酸制备少量纯净的CO,其合理的连接顺序为__________(填字母序号)。


![]()



(2)相同温度条件下,分别用3支试管按下列要求完成实验:
试管 | A | B | C |
加入试剂 | 4mL 0.01mol/L KMnO4 1ml 0.1moL/L H2SO4 2mL 0.1mol/L H2C2O4 | 4mL 0.02mol/L KMnO4 1ml 0.1moL/L H2SO4 2mL 0.1mol/L H2C2O4 | 4mL 0.03mol/L KMnO4 1ml 0.1moL/L H2SO4 2mL 0.1mol/L H2C2O4 |
褪色时间 | 28秒 | 30秒 | 不褪色 |
写出试管B中发生反应的离子方程式____________________;上述实验能否说明“相同条件下,反应物浓度越大,反应速率越快” __________(选填“能”或“不能”);简述你的理由:_______________。
(3)设计实验证明草酸为弱酸的方案及其现象均正确的有(___________)(填序号)。
A.室温下,取0.010mol/L的H2C2O4溶液,测其pH=2;
B.室温下,取0.010mol/L的NaHC2O4溶液,测其pH >7;
C.室温下,取pH=a(a<3)的H2C2O4溶液稀释100倍后,测其pH< a+2;
D.标况下,取0.10mol/L的H2C2O4溶液100mL与足量锌粉反应,收集到H2体积为224mL;
(4)为测定某H2C2O4溶液的浓度,取20.00mL H2C2O4溶液于锥形瓶中,滴入2-3滴指示剂,用0.1000mol/L的NaOH溶液进行滴定,并进行3次平行实验,所用NaOH溶液体积分别为19.98mL、20.02mL和22.02mL。
①所用指示剂为__________;滴定终点时的现象为____________________________________;
②H2C2O4溶液物质的量浓度为__________;
③下列操作会引起测定结果偏高的是__________(填序号)。
A.滴定管在盛装NaOH溶液前未润洗
B.滴定过程中,锥形瓶震荡的太剧烈,以致部分液体溅出
C.滴定前读数正确,滴定终点时俯视读数
D.滴定前读数正确,滴定终点时仰视读数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com