
����Ŀ���������һ�ֳ��õĻ��ʣ��乤ҵ����������ͼ����ش��������⡣

��1��д����Ӧ����B�з�����Ӧ�Ļ�ѧ����ʽ��___��
��2��������C��ͨ�������Ŀ����___���û�ѧ����ʽ���ͣ���C��D������Ӧ�����з����ķ�Ӧ������������ԭ��Ӧ����___ (�Ӧ��������)��
��3��Ũ����һ�㱣������ɫ�Լ�ƿ������������������û�ѧ����ʽ����ԭ��___��
��4��̼��Ũ���ᷴӦ�Ļ�ѧ����ʽ��___��
���𰸡�![]() 4NO+3O2+2H2O=4HNO3 C
4NO+3O2+2H2O=4HNO3 C ![]()
![]()
��������
�����������ڴ������������ɰ���������������е������ڴ��������·�Ӧ����NO��NO������е�������Ӧ����NO2��NO2��ˮ��Ӧ�������ᣬ�����백��������������泥��ݴ˷������
(1)B�а���ת��ΪNO�Ļ�ѧ����ʽΪ��4NH3+5O2 ![]() 4NO+6H2O���ʴ�Ϊ��4NH3+5O2
4NO+6H2O���ʴ�Ϊ��4NH3+5O2 ![]() 4NO+6H2O��
4NO+6H2O��
(2)���������������У�������C��ͨ�������Ŀ���ǽ�һ�����������ɶ���������Ȼ����ˮ��Ӧ����HNO3���䷴Ӧ����ʽΪ��4NO+3O2+2H2O=4HNO3��C��NOת��ΪNO2��������ԭ��Ӧ�����������հ����������ᰱ�Ƿ�������ԭ��Ӧ���ʴ�Ϊ��4NO+3O2+2H2O=4HNO3��C��
(3)Ũ�������������ֽ⣬����Ӧ���������������ֽ�Ļ�ѧ����ʽΪ4HNO3![]() 4NO2��+ O2��+ 2H2O���ʴ�Ϊ��4HNO3
4NO2��+ O2��+ 2H2O���ʴ�Ϊ��4HNO3![]() 4NO2��+ O2��+ 2H2O��
4NO2��+ O2��+ 2H2O��
(4)C��Ũ�����ڼ��������·�������NO2��CO2��H2O���䷴Ӧ�Ļ�ѧ����ʽΪ��![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��


 �ܿ�����ĩ��̾�ϵ�д�
�ܿ�����ĩ��̾�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȤζͼƬ��һ�������������������ظ�����������ļ���ʽ�ṹ�������й������������ȷ����
A. �����ͬ���칹�壨CH3)3CCH (CH3) CH2COOH������Ϊ 2,2,3-��������
B. �����������ͬ���칹���У�����3����һCH3���ṹ���Ҵ����һ�֧���Ĺ���7��(�����������칹��
C. �����ͬ���칹������ˮ��������Է�������Ϊ74���л���Ĺ���8��(�����������칹��
D. �����᳣���³�Һ̬������֬�᳣���³ʹ�̬���ʶ��߲�����ͬһͨʽ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£�������Һ������Ũ�ȹ�ϵʽ��ȷ����
A. pH=5��H2S��Һ�У�c(H+)= c(HS��)=1��10��5mol��L��1
B. pH=a�İ�ˮ��Һ��ϡ��10������pH=b����a=b+1
C. pH=2��H2C2O4��Һ��pH=12��NaOH��Һ���������ϣ�c(Na��)+ c(H��)= c(OH��)+c( HC2O4��)
D. pH��ͬ����CH3COO Na��NaHCO3��NaClO������Һ��c(Na��)������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʮ�Ŵ�ָ���������ȫ���Ρ�Դͷ���Σ�����ʵʩ������Ⱦ�����ж�����Ӯ���챣��ս������NOxΪ��Ҫ�ɷֵ��������ۺ������ǵ�ǰ��Ҫ���о����⡣
������β���е�NO(g)��CO(g)��һ�������¿ɷ������·�Ӧ��
��Ӧ��2NO(g)+ 2CO(g) N2(g) + 2CO2(g) ��H1��
(1)��֪����Ӧ��N2(g)+O2(g) 2NO(g) ��H2= +180.5 kJ��mol-1��CO��ȼ����Ϊ283.0 kJ��mol-1������H1=____��
(2)���ܱ������г���5molCO��4molNO������������Ӧ�٣�ͼ1Ϊƽ��ʱNO������������¶ȡ�ѹǿ�Ĺ�ϵ��
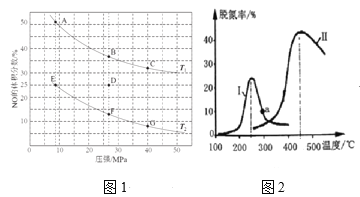
���¶ȣ�T1____T2(����������������) ��
������D��Է�Ӧ�������µ�ͬʱ�������ʹ��ϵѹǿ��С�����´ﵽ��ƽ��״̬������ͼ��A~G���е�____�㡣
(3)ij�о�С��̽��������CO��NOת����Ӱ�졣��NO��CO��һ��������ͨ�����ֲ�ͬ�Ĵ������з�Ӧ����ͬʱ���ڲ����ݳ�������NO�������Ӷ�ȷ��β���ѵ���(�ѵ��ʼ�NO��ת����)�������ͼ2��ʾ��������200�棬ͼ2�����ߢ��ѵ������¶����߶��仯�������Ҫԭ��Ϊ______��a��_____(������������������)��Ӧ�¶��µ�ƽ���ѵ��ʣ�˵��������______��
II��N2O��һ��ǿ�������壬�����γɿ�������Ⱦ��о�N2O�ķֽ�Ի�����������Ҫ���塣
(4)�����������ܴ�������N2O�ķֽ����ʣ���Ӧ����Ϊ��
��һ��I2(g) 2I(g) (�췴Ӧ)
�ڶ���I(g)+N2O(g) �� N2(g)+IO(g) (����Ӧ)
������IO(g)+N2O(g) �� N2(g)+O2(g)+I2(g) (�췴Ӧ)
ʵ�����������ʱN2O�ֽ����ʷ���v = k��c(N2O)��[c(I2)]0.5(kΪ���ʳ���)�����б�����ȷ����____��
A��I2Ũ����N2O�ֽ����� B���ڶ������ܷ�Ӧ�������������
C���ڶ�����ܱȵ�����С D��IOΪ��Ӧ���м����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼��������������������ѧ�����ķǽ���Ԫ�أ������ӿ�����������ɵ�SCN����CN����F�����γɺܶ������
��1����̬Feԭ���У�����ռ�ݵ�����ܲ����Ϊ____�����ܲ���е�ԭ�ӹ����Ϊ_____,������Ϊ______��
��2����֪��CN��2��ֱ���ͷ��ӣ����жԳ��ԣ���CN��2�Цм��ͦҼ��ĸ�����Ϊ______���������Fe��SCN��2+�У��ṩ�չ�����ܹ¶Ե��ӵ�����______��
��3�������K4[Fe��CN��6]�в����ڵ�������_______������ţ���
A�����ۼ� B�����Ӽ� C���Ǽ��Լ� D����λ��
��4��д��һ����SCN����Ϊ�ȵ�����ķ���_________���û�ѧʽ��ʾ�����÷��ӵĿռ乹��Ϊ___________________��
��5����(N2H4)���������ȼ�ϣ�ȼ��ʱ�����ķ�Ӧ�ǣ�N2O4(l)��2N2H4(l)=3N2(g)��4H2O(g)��H=-1038.7kJ��mol-1�����÷�Ӧ����4mol N-H�����ѣ����γɵĦм���________mol��
��6��ͼ1��ʾij�ֺ����л�������Ľṹ���������4����ԭ�ӷֱ�λ�����������4�����㣨��ͼ2���������ڴ��ڿ�ǻ����Ƕ��ij���ӻ���Ӳ��γ�4���������ʶ��

���з��ӻ������У��ܱ����л�������ʶ�����_________�����ţ���
a. CF4 b. CH4 c. NH4�� d. H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ԫ�صĻ�̬ԭ�ӵĵ����Ų�ʽ:
��![]() �� ��
�� ��![]() ��
��
��![]() �� ��
�� ��![]() ��
��
�������йرȽ�����ȷ����
A. �縺��:��>��>��>�� B. ԭ�Ӱ뾶:��>��>��>��
C. ��һ������:��>��>��>�� D. ��������ϼ�:��>��=��>��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NAΪ�����ӵ�������ֵ������˵����ȷ����
A. ��״���£�0.1molCl2����ˮ��ת�Ƶĵ�����ĿΪ0.1NA
B. ��״���£�6.72LNO2��ˮ��ַ�Ӧת�Ƶĵ�����ĿΪ0.1NA
C. 1.0L1.0mo1��L��1 ��NaAlO2ˮ��Һ�к��е���ԭ����Ϊ2NA
D. ���³�ѹ�£�14g��N2��CO��ɵĻ�����庬�е�ԭ����ĿΪNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NaCl��һ�ֻ���ԭ�ϣ������Ʊ�һϵ�����ʣ���ͼ��ʾ������˵����ȷ���ǣ� ��

A.Cl2��Ư�۵����ӷ���ʽΪCl2+2OH-=Cl-+ClO-
B.��ⱥ��ʳ��ˮ���ڽ����Ƶ���ȡ
C.�����������е�ȼ��������ˮ�������ڹ�ҵ��ȡ����
D.�����ƼӦ�������ʵ��ܽ��ԣ������з����ľ��Ƿ�������ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ϊȼ�ϵ�����ȼ�ϵ�ؽṹʾ��ͼ��ͼ��ʾ�����ڸõ�ص�������ȷ����
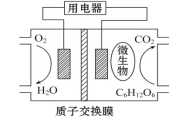
A. �õ���ܹ��ڸ����¹���
B. ��صĸ�����ӦΪC6H12O6+6H2O-24e-====6CO2��+24H+
C. �ŵ�����У�H+������������Ǩ��
D. �ڵ�ط�Ӧ�У�ÿ����1 mol������������������CO2����22.4L
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com