
【题目】已知一定条件下合成氨反应:N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92.4 kJ·mol-1 , 在反应过程中,反应速率的变化如图所示,请根据速率的变化回答采取的措施。
2NH3(g) ΔH=-92.4 kJ·mol-1 , 在反应过程中,反应速率的变化如图所示,请根据速率的变化回答采取的措施。
t1; t2; t3; t4。
【答案】增大氮气或氢气浓度;加催化剂;降温;增大压强
【解析】解:t1时正反应速率增大,且大于逆反应速率,则平衡正向移动,则应为增大反应物浓度,增大氮气或氢气浓度;t2时正逆反应速率同等程度增大,则为使用了催化剂;t3时正反应速率减小,且正反应速率大于逆反应速率,则平衡正向移动,则为降低温度;t4时正反应速率增大,且大于逆反应速率,则平衡正向移动,则应为增大压强,所以答案是:增大反应物浓度;催化剂;降低温度;增大压强。
【考点精析】利用化学反应速率的调控作用对题目进行判断即可得到答案,需要熟知同一反应里用不同物质来表示的反应速率数值可以是不同的,但这些数值,都表示同一反应速率,且不同物质的速率比值等于其化学方程式中的化学计量数之比.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】S2Cl2分子结构如图所示。常温下,S2Cl2遇水易水解并产生能使品红褪色的气体。下列说法不正确的是

A. S2Cl2分子中所有原子不在同一平面
B. 13.5 gS2Cl2中共价键的数目为0.4NA
C. S2Cl2与水反应时S-S、S-C1键都断裂
D. S2Cl2中S-S键和S-C1键是共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应A2+ B2= 2AB的能量变化如图所示,则下列说法正确的是( )

A. 该反应是吸热反应
B. 断裂1 mol A—A键和1 mol B—B键能放出x kJ的能量
C. 断裂2 mol A—B键需要吸收y kJ的能量
D. 2 mol AB的总能量高于1 mol A2和1 mol B2的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“分子筛”是一种具有多孔结构的铝硅酸盐(NaAlSiO4·nH2O),其中有许多笼状孔穴和通道,能让直径比孔穴小的分子通过而将大的分子留在外面,故此得名。利用铝灰(主要成分为Al、Al2O3、AlN、FeO等)制备“分子筛”的一种工艺流程如下:

(1)“分子筛”的化学式用氧化物形式可表示为_______________。
(2)铝灰水解产生的气体为________(填化学式),该气体分子中极性键的数目为___________;“水解”在加热条件下而不在室温下进行的原因是________________________。
(3)“酸溶”时,发生氧化还原反应的离子方程式为_________________________________。
(4)该工艺中滤渣的颜色为________________________。
(5)某学习小组设计实验模拟从浓缩海水(含Ca2+、Mg2+、SO42-)中提取试剂级NaCl:
![]()
①实验中若向浓缩海水中加入的是Na2CO3浓溶液,则有难溶的Mg2(OH)2CO3生成,同时有气体逸出。该反应的离子方程式为__________________________________。
②该学习小组发现上述实验即使BaCl2用量不足,第Ⅲ步沉淀中依然含有少量BaCO3。从平衡角度分析其原因:_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将气体A、B置于体积为1L的密闭容器中,发生如下反应:4A(g)+B(g) =2C(g) 反应进行到4s末,测得A为0.5 mol,B为0.4 mol, C为0.2mol。则用v(A)表示的该反应的速率为 , 用v(B)表示的该反应的速率为 , 用v(C)表示的该反应的速率为。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.124g P4含有的P﹣P键数为4NA(设NA表示阿伏伽德罗常数的值)
B.Be和NaOH溶液反应的离子方程式是:2Be+2OH ﹣+2H2O=2BeO2﹣+3H2↑
C.在NaCl溶液中加入AgNO3溶液,生成白色沉淀;再加入氨水,沉淀消失,沉淀消失发生的离子方程式是:
AgCl+2NH3H2O=[Ag(NH3)2]++Cl﹣+2H2O
D.0.1mol/L的Fe3+溶液中,能大量共存的离子有Cl﹣、SO42﹣、SCN﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有四种不同堆积方式的金属晶体的晶胞如图所示,有关说法正确的是( )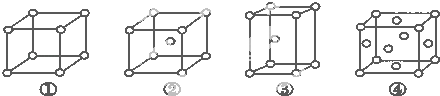
A.①为简单立方堆积②为六方最密堆积③为体心立方堆积④为面心立方最密堆积
B.每个晶胞含有的原子数分别为:①1个,②2个,③2个,④4个
C.晶胞中原子的配位数分别为:①6,②8,③8,④12
D.空间利用率的大小关系为:①<②<③<④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究原电池原理,设计如图装置。下列叙述不正确的是

A. a和b不连接时,Fe极上析出红色物质
B. a和b连接时,SO42-向Fe极移动
C. 这种原电池可以提供持续、稳定的电流
D. 该原电池反应的离子方程式为:Cu2++Fe=Cu+Fe2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com