
【题目】已知常温下0.1mol/L的NH4HCO3溶液pH=7.8,已知含氮(或含碳)各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与pH的关系如图所示.下列说法不正确的是( ) 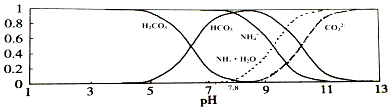
A.溶液的pH=9时,溶液中存在下列关系:c(HCO3﹣)>c(NH4+)>c(NH3H2O)>c(CO32﹣)
B.NH4HCO3溶液中存在下列守恒关系:c(NH4+)+c(NH3H2O)=c(HCO3﹣)+c(CO32﹣)+c(H2CO3)
C.由图可知,往该溶液中逐滴滴加氢氧化钠时NH4+和HCO3﹣浓度逐渐减小
D.通过分析可知常温下Ka1(H2CO3)>Kb(NH3H2O)>Ka2(H2CO3)
【答案】CD
【解析】解:A.结合图象可知,溶液的pH=9时,溶液中离子浓度大小为:c(HCO3﹣)>c(NH4+)>c(NH3H2O)>c(CO32﹣),故A正确;B.NH4HCO3溶液中存在物料守恒:c(NH4+)+c(NH3H2O)=c(HCO3﹣)+c(CO32﹣)+c(H2CO3),故B正确;
C.0.1mol/L的NH4HCO3溶液的pH=7.8,根据图象可知,当溶液pH增大时,铵根离子浓度逐渐减小,而碳酸氢根离子能够先增大后减小,故C错误;
D.由于0.1mol/L的NH4HCO3溶液的pH=7.8,说明碳酸氢根离子的水解程度大于铵根离子的水解程度,则Kb(NH3H2O)大于Ka1(H2CO3),故D错误;
故选CD.
A.当pH=9时,结合图象判断溶液中各离子浓度大小;
B.根据碳酸氢铵溶液中的物料守恒分析;
C.该碳酸氢铵溶液的pH=7.8,结合图象判断滴入氢氧化钠溶液后NH4+和HCO3﹣浓度变化;
D.碳酸氢啊溶液显示碱性,根据盐的水解原理判断二者的酸碱性强弱及电离平衡常数大小.


科目:高中化学 来源: 题型:
【题目】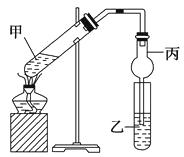
如图在试管甲中先加入2 mL95%的乙醇,并在振荡下缓慢加入2 mL浓硫酸,充分摇匀,冷却后再加入2 g无水乙酸钠(CH3COONa)。将试管甲固定在铁架台上,在试管乙中加入5 mL饱和碳酸钠溶液,按图连接好装置进行实验,当试管乙中有明显现象时停止实验。
试回答:
(1)实验时,应对试管甲缓慢加热,其目的是。
(2)写出试管甲中发生反应的化学方程式:。
(3)加入浓硫酸的作用是、、。
(4)该实验中球形管丙的作用是。
(5)某同学做此实验时,观察到反应混合液变黑,并闻到刺激性气味,试分析其原因:。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组微粒中,在一定条件下均可以作氧化剂的是
A.F-、Br-、S2- B.Fe3+、MnO4-、NO3-
C.Cl2、HClO、Mg D.ClO-、Cl-、Ag+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据《天工开物》记载我国古代以炉甘石(主要成分是ZnCO3)来升炼倭铅(即锌),其原理如图2。已知锌的熔点420℃、沸点906℃。则下列说法不正确的是
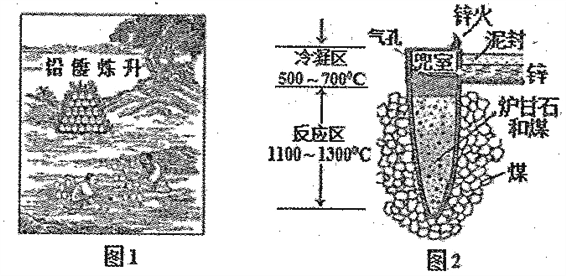
A. 升炼佞铅过程包含氧化还原反应
B. “锌火”是锌蒸气和-氧化碳在空气的燃烧
C. “泥封”的目的是为了防止得到的锌被氧化
D. 冶炼时锌变为蒸气在兜室冷凝为固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:①将碱式滴定管用蒸馏水洗净,待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入20.00mL待测溶液到锥形瓶中.②将酸式滴定管用蒸馏水洗净,再用标准酸液润洗2﹣3次后,向其中注入0.1000molL﹣1标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数.
③向锥形瓶中滴入酚酞作指示剂,进行滴定.滴定至指示剂刚好变色,且半分钟内颜色不再改变为止,测得所耗盐酸的体积为V1mL.
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL.
滴定次数 | 待测液体积(mL) | 标准盐酸体积/mL | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 25.00 | 0.50 | 20.40 |
第二次 | 25.00 | 4.00 | 24.00 |
试回答下列问题:
(1)步骤③中锥形瓶中的溶液的颜色变化是由色时,停止滴定.
(2)滴定时边滴边摇动锥形瓶,眼睛应观察 .
(3)该小组在步骤①中的错误是 , 由此造成的测定结果(填“偏高”、“偏低”或“无影响”).
(4)步骤②缺少的操作是 .
(5)如图,是某次滴定时的滴定管中的液面,其读数为mL.![]()
请计算待测烧碱溶液的浓度:mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数,下列说法正确的是
A. 常温下,5.6g铁与足量的盐酸反应,失去的电子数为0.2NA
B. 标准状况下11.2L二氧化硫中含有的原于数为2NA
C. 标准状况下,22.4L氯气发生反应转移电子数一定为2NA
D. 0.1mol/LCuCl2溶液中Cl-数目是0.2NA
【答案】A
【解析】 A、因为Fe和盐酸反应氧化产物是Fe 2+ ,5.6 g铁失去电子数为0.2 N A,选项A错误;B、B. 标准状况下11.2L二氧化硫中含有的原子数为![]() 3NA=3NA,选项B错误;C、1 mol 氯气参加反应时,氯气可以只做氧化剂,也可以自身氧化还原反应,电子转移数目可以为2NA或NA,选项C错误;D、溶液体积不明确,故溶液中的氯离子的个数无法计算,选项D错误。答案选A。
3NA=3NA,选项B错误;C、1 mol 氯气参加反应时,氯气可以只做氧化剂,也可以自身氧化还原反应,电子转移数目可以为2NA或NA,选项C错误;D、溶液体积不明确,故溶液中的氯离子的个数无法计算,选项D错误。答案选A。
【题型】单选题
【结束】
23
【题目】实验室利用以下反应制取少量氨气:NaNO2+NH4Cl=NaC1+N2↑+2H2O,关于该反应的下列说法正确的是
A. NaNO2发生氧化反应
B. 每生成1molN2转移的电子的物质的量为3mol
C. NH4Cl中的氯元素被还原
D. N2既是氧化剂,又是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置不能达到实验目的的是
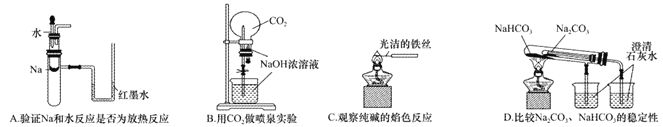
A. A B. B C. C D. D
【答案】D
【解析】A.钠与水反应放热,试管中温度升高,导致气体压强增大,红墨水出现液面差,可以达到实验目的,A正确;B.二氧化碳与氢氧化钠反应,压强减小,形成喷泉,可以达到实验目的,B正确;C.铁丝的焰色反应为无色,可用来做纯碱的焰色反应,能够达到实验目的,C正确;D.套装小试管加热温度较低,碳酸氢钠应放在套装小试管中,通过澄清水是否变浑浊可证明稳定性,题中装置无法达到实验目的,D错误;答案选D。
【题型】单选题
【结束】
18
【题目】下列反应中,反应条件、加液顺序、反应物用量或浓度等改变时,反应产物均不发生变化的是
A. 氢氧化钠与二氧化碳反应 B. 盐酸和碳酸氢钠溶液
C. 铜与硝酸反应 D. 氯化铝溶液和氢氧化钠溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A.常温常压下,8 g O2含有4NA个电子
B.1 L 0.1 molL﹣1的氨水中有NA个NH4+
C.标准状况下,22.4 L盐酸含有NA个HCl分子
D.1 mol Na被完全氧化生成Na2O2 , 失去2NA个电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com