
����Ŀ��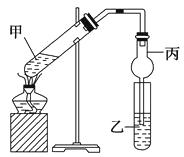
��ͼ���Թܼ����ȼ���2 mL95%���Ҵ����������»�������2 mLŨ���ᣬ���ҡ�ȣ���ȴ���ټ���2 g��ˮ������(CH3COONa)�����Թ̶ܼ�������̨�ϣ����Թ����м���5 mL����̼������Һ����ͼ���Ӻ�װ�ý���ʵ�飬���Թ���������������ʱֹͣʵ�顣
�Իش�
��1��ʵ��ʱ��Ӧ���Թܼ������ȣ���Ŀ������
��2��д���Թܼ��з�����Ӧ�Ļ�ѧ����ʽ����
��3������Ũ�����������������
��4����ʵ�������ιܱ�����������
��5��ijͬѧ����ʵ��ʱ���۲쵽��Ӧ���Һ��ڣ����ŵ��̼�����ζ���Է�����ԭ����
���𰸡�
��1�������Ҵ�������Ļӷ������ٸ���Ӧ�ķ������ӿ컯ѧ��Ӧ����
��2��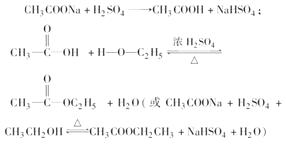
��3����Ӧ��(����ȡ����)����������ˮ��
��4����ֹ����
��5�������¶ȹ���ʹ�л�����ˮ��̼���ɣ�Ũ���ᱻ��ԭΪSO2
��������������ʵ������ȡ����������ʵ�飬ʵ���е��������������ƺ����ᷴӦ�����ģ�ʵ����ʹ���˸��������ֹ����������ʹ�ø����ֻ�õ��ܣ�����ĩ�˾Ͳ��ܲ��뱥��̼������Һ�С�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������Ũ������������̷�Ӧ��ȡ�����������й�˵������ȷ����(���������.����²ⶨ)( )
A. ���ṩ0.4 mol HCl��MnO2����������Ƶ�����4.48 L
B. ���ṩ0.4 mol HCl��MnO2��������ת�Ƶ�����һ��Ϊ0.1mol
C. ����0.4 mol HCl�μӷ�Ӧ������Ƶ�����2.24 L
D. ����0.4 mol HCl������������Ƶ�����2.24 L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼�������(DMC����һ�����������������졢��;�㷺�Ļ���ԭ�ϣ��ڴ��������£����ɼ״���CO2ֱ�Ӻϳ�̼���������CO2+2CH3OH��CO(OCH3��2 + H2O ��ij�о�С���������������������£�ͨ���о����������ֱ��ת������TON �� ��Ӱ�������۴����Ĵ�Ч�������㹫ʽΪTON��ת���ļ״������ʵ��������������ʵ��������ݸ��о�С���ʵ�鼰��������TON��Ӱ��ͼ���ж�����˵������ȷ���ǣ� ��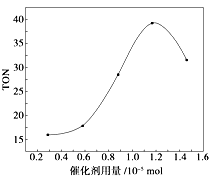
A.�ɼ״���CO2ֱ�Ӻϳ�̼����������������ü����õļ״���Ӱ�컷������������CO2ת��Ϊ��Դ������Դѭ�����úͻ����������涼������Ҫ����
B.�ڷ�Ӧ��ϵ�����Ӻ��ʵ���ˮ��������߸÷�Ӧ��TON
C.����������Ϊ1.2��10-5molʱ���÷�Ӧ��TON �ﵽ��ߵ�
D.��������������1.2��10-5molʱ�����Ŵ������������ӣ��״���ƽ��ת��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ײ������ӵ�ֱ��Ϊ1-100nm�����з�ɢϵ�з�ɢ�ʵ���ֱ�������ײ���������ͬ��������( )��
A.��ҺB.����ҺC.����D.����Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ͼ���������������У���ȷ����( )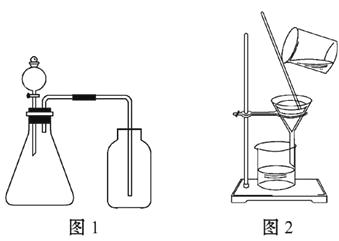
A.ͼ1��ʾװ�ÿ����ڷֱ���ȡ����NO��H2
B.ͼ1��ʾװ�ÿ�������֤�����ԣ�KMnO4��Cl2
C.ϴ�ӳ���ʱ(��ͼ2)����©���м�����ˮ�����貢�˸�
D.����ͼ2��ʾ�ķ��������ᴿ����������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧС���Ա�����Ϊԭ�ϣ���ȡ�������������֪�й����ʵķе����±���
���� | �״� | ������ | ��������� |
�е�/�� | 64��7 | 249 | 199��6 |
�ϳɱ���������ֲ�Ʒ
��Բ����ƿ�м���12��2g�������20ml�״����ܶ�Լ0��79g��mL-1 ��,��С�ļ���3mLŨ���ᣬ���Ⱥ�Ͷ�뼸�����Ƭ��С�ļ���ʹ��Ӧ��ȫ���ñ���������ֲ�Ʒ����
��1��Ũ�������������
�������Һ��ʱ������Ũ��������ɣ���
��2���ס��ҡ�����λͬѧ�ֱ����������ͼ����ʵ���Һϳɱ����������װ�ã��г������ͼ�������������ȥ���������л���ķе㣬��ò���װ�ã���ס����ҡ���������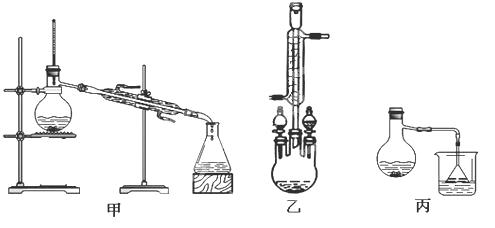
�ֲ�Ʒ�ľ���
��3������������ֲ�Ʒ���������������״������ᡢ�������ˮ�ȣ��������������̽��о��ƣ����������ͼд���������������ơ������� ��������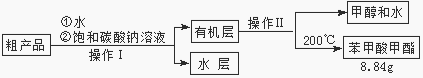
��4���ܷ���NaOH��Һ���汥��̼������Һ������ܡ�����
������ԭ����
��5��ͨ�����㣬����������IJ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Ƽ����ѧ��Ӧԭ��ΪNaCl+CO2+NH3+H2O=NaHCO3��+NH4C1����ͼģ�⡰�����Ƽ����ȡNaHCO3�IJ���װ�á����в�����ȷ����
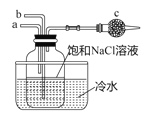
A. aͨ��CO2,Ȼ��bͨ��NH3,c�зż�ʯ��
B. bͨ��NH3,Ȼ��aͨ��CO2c�зż�ʯ��
C. aͨ��NH3,Ȼ��bͨ��CO2,c�з�պϡ�������֬��
D. bͨ��CO2Ȼ��aͨ��NH3,c�з�պϡ�������֬��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪������0.1mol/L��NH4HCO3��ҺpH=7.8����֪��������̼�������ķֲ�������ƽ��ʱij������Ũ��ռ������Ũ��֮�͵ķ�������pH�Ĺ�ϵ��ͼ��ʾ������˵������ȷ���ǣ� �� 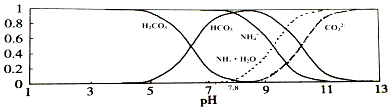
A.��Һ��pH=9ʱ����Һ�д������й�ϵ��c��HCO3������c��NH4+����c��NH3H2O����c��CO32����
B.NH4HCO3��Һ�д��������غ��ϵ��c��NH4+��+c��NH3H2O��=c��HCO3����+c��CO32����+c��H2CO3��
C.��ͼ��֪��������Һ����εμ���������ʱNH4+��HCO3��Ũ����С
D.ͨ��������֪������Ka1��H2CO3����Kb��NH3H2O����Ka2��H2CO3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ϲ��õ�һ����ˮ�����������£�������ˮ��pH��5.0��6.0֮�䣬ͨ���������Fe��OH��3 �� Fe��OH��3���������ԣ�����������������������о���ˮ�����ã��������������ݰ���ˮ�����������ˮ���γɸ����㣬��ȥ����Ʋ���������㣬�����˸�ѡ���������ã�ij����С���ø�ԭ��������ˮ�����װ����ͼ��ʾ������˵����ȷ���ǣ�������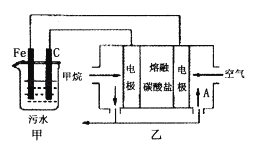
A.Ϊ��ʹ��ȼ�ϵ�س�ʱ���ȶ����У���صĵ�������Ӧ�����ȶ�����ع���ʱ��ѭ��������AΪCO2
B.��װ���������ķ�ӦΪFe��2e���TFe2+
C.Ϊ��������ˮ�ĵ���������Ӧ����ˮ������������NaOH��Һ
D.����װ������1.6 g CH4�μӷ�Ӧ����C�缫���������������ڱ�״����Ϊ4.48 L
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com