
【题目】某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:①将碱式滴定管用蒸馏水洗净,待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入20.00mL待测溶液到锥形瓶中.②将酸式滴定管用蒸馏水洗净,再用标准酸液润洗2﹣3次后,向其中注入0.1000molL﹣1标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数.
③向锥形瓶中滴入酚酞作指示剂,进行滴定.滴定至指示剂刚好变色,且半分钟内颜色不再改变为止,测得所耗盐酸的体积为V1mL.
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL.
滴定次数 | 待测液体积(mL) | 标准盐酸体积/mL | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 25.00 | 0.50 | 20.40 |
第二次 | 25.00 | 4.00 | 24.00 |
试回答下列问题:
(1)步骤③中锥形瓶中的溶液的颜色变化是由色时,停止滴定.
(2)滴定时边滴边摇动锥形瓶,眼睛应观察 .
(3)该小组在步骤①中的错误是 , 由此造成的测定结果(填“偏高”、“偏低”或“无影响”).
(4)步骤②缺少的操作是 .
(5)如图,是某次滴定时的滴定管中的液面,其读数为mL.![]()
请计算待测烧碱溶液的浓度:mol/L.
【答案】
(1)红色变为无
(2)锥形瓶内溶液颜色的变化
(3)待测溶液润洗锥形瓶;偏高
(4)用蒸馏水后再用标准溶液润洗
(5)22.60;0.08
【解析】解:(1)因滴定终点时,锥形瓶中的溶液从红色变为无色时,且半分钟内不变色,停止滴定;故答案为:红色变为无;(2)滴定时眼睛应观察锥形瓶内溶液颜色的变化,以判定终点的到达;故选:锥形瓶内溶液颜色的变化; (3)锥形瓶用蒸馏水洗净即可,不能用待测溶液润洗,否则,待测溶液偏多,所以消耗标准液的体积偏大,根据c(待测)= ![]() 可知,c(待测)偏高;故答案为:待测溶液润洗锥形瓶;偏高;(4)将酸式滴定管用蒸馏水洗净后,立即向其中注入标准稀溶液,则标准溶液的浓度偏小,所以缺少的操作为:用蒸馏水后再用标准溶液润洗;故答案为:用蒸馏水后再用标准溶液润洗;(5)待测液的物质的量不变,读数时目光平视,凹液面最低点与刻度线相切,所以读数为22.60mL;故答案为:22.60;(6)两次消耗的盐酸标准液的体积为19.90mL,20.00mL,均有效,标准盐酸溶液的平均体积为19.95mL, HCl~NaOH
可知,c(待测)偏高;故答案为:待测溶液润洗锥形瓶;偏高;(4)将酸式滴定管用蒸馏水洗净后,立即向其中注入标准稀溶液,则标准溶液的浓度偏小,所以缺少的操作为:用蒸馏水后再用标准溶液润洗;故答案为:用蒸馏水后再用标准溶液润洗;(5)待测液的物质的量不变,读数时目光平视,凹液面最低点与刻度线相切,所以读数为22.60mL;故答案为:22.60;(6)两次消耗的盐酸标准液的体积为19.90mL,20.00mL,均有效,标准盐酸溶液的平均体积为19.95mL, HCl~NaOH
1 1
0.1000molL﹣1×19.95mL c( NaOH)×25.00mL
解得:c( NaOH)=0.08mol/L;
故答案为:0.08.
(1)根据滴定终点,溶液颜色发生变化,且半分钟内不变色,应停止滴定;(2)根据滴定时眼睛应观察锥形瓶内溶液颜色的变化;(3)根据待测溶液润洗锥形瓶,会使的待测液的物质的量增多;根据c(待测)= ![]() 分析误差;(4)将酸式滴定管用蒸馏水洗净后,立即向其中注入标准稀溶液,则标准溶液的浓度偏小,所以要用标准溶液润洗;(5)读数时目光平视,凹液面最低点与刻度线相切;(6)先判断数据的合理性,然后盐酸溶液的平均体积,然后根据HCl~NaOH求NaOH溶液的物质的量浓度;
分析误差;(4)将酸式滴定管用蒸馏水洗净后,立即向其中注入标准稀溶液,则标准溶液的浓度偏小,所以要用标准溶液润洗;(5)读数时目光平视,凹液面最低点与刻度线相切;(6)先判断数据的合理性,然后盐酸溶液的平均体积,然后根据HCl~NaOH求NaOH溶液的物质的量浓度;


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】(一)为了达到下表中的实验要求,请选择合适的试剂及方法,将其标号填入对应的空格中。
实验要求 | 试剂及方法 | ||
鉴别Na2SO4溶液和NaCl溶液 | A.分别加入氯化钡溶液,观察现象 | ||
证明盐酸溶液呈酸性 | B.将气体分别通过盛有品红溶液的洗气瓶 | ||
鉴别二氧化硫和二氧化碳 | C.加入几滴碘水,观察现象 | ||
检验淘米水中是否含有淀粉 | D.在溶液滴加紫色石蕊,溶液变红 | ||
(二).甲、乙两同学用下图所示装置进行实验,探究硝酸与铁反应的产物 .
文献记载:I.在浓硝酸和活泼金属反应过程中,随着硝酸浓度的降低,其生成的产物有+4、+2、-3价等氮的化合物.
II.FeSO4+NOFe(NO)SO4(棕色)△H<0.
III.NO2和NO都能被KMnO4氧化吸收.
甲的实验操作和现象记录如下:
|
请回答下列问题:
(1)滴入浓硝酸加热前没有明显现象的原因是 .
(2)检验是否生成-3价氮的化合物,应进行的实验操作是 .
(3)证明A溶液中是否含有Fe3+ , 选择的药品是(填序号)( )
A.铁粉
B.溴水
C.铁氰化钾溶液
D.硫氰化钾溶液.
(4)根据实验现象写出A中一定发生反应的化学方程式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组以苯甲酸为原料,制取苯甲酸甲酯。已知有关物质的沸点如下表:
物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
沸点/℃ | 64.7 | 249 | 199.6 |
Ⅰ.合成苯甲酸甲酯粗产品
在圆底烧瓶中加入12.2g苯甲酸和20ml甲醇(密度约0.79g·mL-1 ),再小心加入3mL浓硫酸,混匀后,投入几粒碎瓷片,小心加热使反应完全,得苯甲酸甲酯粗产品。‘
(1)浓硫酸的作用是;
简述混合液体时最后加入浓硫酸的理由:。
(2)甲、乙、丙三位同学分别设计了如下图三套实验室合成苯甲酸甲酯的装置(夹持仪器和加热仪器均已略去)。根据有机物的沸点,最好采用装置(填“甲”或“乙”或“丙”)。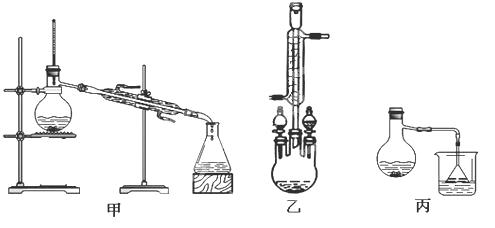
Ⅱ.粗产品的精制
(3)苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,现拟用下列流程进行精制,请根据流程图写出操作方法的名称。操作Ⅰ 操作Ⅱ。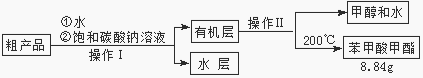
(4)能否用NaOH溶液代替饱和碳酸钠溶液?(填“能”或“否”),
并简述原因。
(5)通过计算,苯甲酸甲酯的产率是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下0.1mol/L的NH4HCO3溶液pH=7.8,已知含氮(或含碳)各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与pH的关系如图所示.下列说法不正确的是( ) 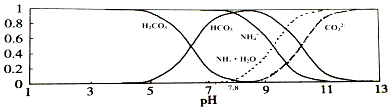
A.溶液的pH=9时,溶液中存在下列关系:c(HCO3﹣)>c(NH4+)>c(NH3H2O)>c(CO32﹣)
B.NH4HCO3溶液中存在下列守恒关系:c(NH4+)+c(NH3H2O)=c(HCO3﹣)+c(CO32﹣)+c(H2CO3)
C.由图可知,往该溶液中逐滴滴加氢氧化钠时NH4+和HCO3﹣浓度逐渐减小
D.通过分析可知常温下Ka1(H2CO3)>Kb(NH3H2O)>Ka2(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了预防碘缺乏病,有关部门规定食盐中的碘含量(以I计)应在20~50mg/kg。制备KIO3的方法如下:
方法1:6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑,KH(IO3)2+KOH=2KIO3+H2O
方法2:碱性条件下,KI+3H2O ![]() KIO3+3H2↑
KIO3+3H2↑
方法3:I2![]() HIO3
HIO3![]() KIO3
KIO3
(1)与方法3相比方法1的不足是 ,
方法2的不足是。
(2)方法2选用的电极是惰性电极,则其阳极反应式是?
(3)方法3反应温度控制在70 ℃左右,不采用更高温度的主要原因是?
(4)制备纯净KIO3的实验步骤中,最后需将所得晶体最好使用洗涤2~3次,干燥后得产品。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在,实验室里从海藻中提取碘的流程如下: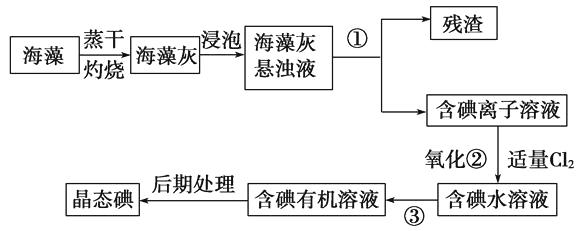
(1)指出提取碘的过程中有关的实验操作名称:
①、③。写出过程②中有关反应的离子方程式
;
(2)提取碘的过程中,可供选择的有机试剂是()
A.甲苯、酒精
B.四氯化碳、苯
C.汽油、乙酸
D.汽油、甘油
(3)为使海藻灰中碘离子转化为碘的有机溶液,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品,尚缺少的玻璃仪器是;
(4)从含碘的有机溶液中提取碘和回收有机溶剂,还需经过蒸馏,指出实验装置中的错误之处:①;②;③。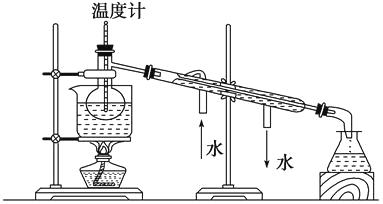
(5)进行上述蒸馏操作时,使用水浴的原因是 , 最后晶体碘在里聚集。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列烷烃在光照下与氯气反应,只生成一种一氯代烃的是( )
A.CH3CH2CH2CH3
B.CH3CH(CH3)2
C.CH3C(CH3)3
D.(CH3)2CHCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列冶炼金属的原理中,属于热还原法的是( )
A.2Ag2O ![]() 4Ag+O2↑
4Ag+O2↑
B.Fe2O3+3CO ![]() 2Fe+3CO2↑
2Fe+3CO2↑
C.Fe+CuSO4=FeSO4+Cu
D.MgC12 ![]() Mg+C12↑
Mg+C12↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com