
【题目】为了预防碘缺乏病,有关部门规定食盐中的碘含量(以I计)应在20~50mg/kg。制备KIO3的方法如下:
方法1:6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑,KH(IO3)2+KOH=2KIO3+H2O
方法2:碱性条件下,KI+3H2O ![]() KIO3+3H2↑
KIO3+3H2↑
方法3:I2![]() HIO3
HIO3![]() KIO3
KIO3
(1)与方法3相比方法1的不足是 ,
方法2的不足是。
(2)方法2选用的电极是惰性电极,则其阳极反应式是?
(3)方法3反应温度控制在70 ℃左右,不采用更高温度的主要原因是?
(4)制备纯净KIO3的实验步骤中,最后需将所得晶体最好使用洗涤2~3次,干燥后得产品。
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案科目:高中化学 来源: 题型:
【题目】某化学兴趣小组设置了如图所示的实验装置,即可用于制取气体,又可用于验证物质的性质,下列说法不正确的是( )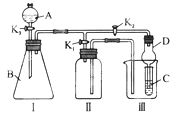
A.利用I、II装置制取气体(K2关闭、K1打开),可以收集H2等气体,但不能收集O2、NO气体
B.利用II装置作简单改进(但不改变瓶口朝向)后,可以收集O2、NO等气体,但不能收集NO2气体
C.利用I、Ⅲ装置可以比较H2SO4、H2CO3和H2SiO3的酸性强弱
D.利用I、Ⅲ装置既能验证氧化性:Ca(ClO)2>Cl2>Br2 , 又能保护环境
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组设计的实验室制取乙酸乙酯的装置如下图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸,D中放有饱和碳酸钠溶液。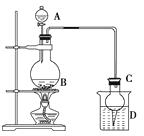
已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH;
②有关有机物的沸点如下:
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
请回答:
(1)若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式: 。
(2)球形干燥管C的作用是。若反应前向D中加入几滴酚酞,溶液呈红色,产生此现象的原因是(用离子方程式表示);
反应结束后D中的现象是。
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出;再加入(此空从下列选项中选择),然后进行蒸馏,收集77 ℃左右的馏分,以得到较纯净的乙酸乙酯。
A.五氧化二磷 B.碱石灰
C.无水硫酸钠 D.生石灰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1mol/LNaOH溶液的含义是( )
A.1L溶液中含有40gNaOHB.1L水中含有1molNaOH
C.溶液中含有1molNaOHD.将40gNaOH溶于1L水中所得的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:①将碱式滴定管用蒸馏水洗净,待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入20.00mL待测溶液到锥形瓶中.②将酸式滴定管用蒸馏水洗净,再用标准酸液润洗2﹣3次后,向其中注入0.1000molL﹣1标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数.
③向锥形瓶中滴入酚酞作指示剂,进行滴定.滴定至指示剂刚好变色,且半分钟内颜色不再改变为止,测得所耗盐酸的体积为V1mL.
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL.
滴定次数 | 待测液体积(mL) | 标准盐酸体积/mL | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 25.00 | 0.50 | 20.40 |
第二次 | 25.00 | 4.00 | 24.00 |
试回答下列问题:
(1)步骤③中锥形瓶中的溶液的颜色变化是由色时,停止滴定.
(2)滴定时边滴边摇动锥形瓶,眼睛应观察 .
(3)该小组在步骤①中的错误是 , 由此造成的测定结果(填“偏高”、“偏低”或“无影响”).
(4)步骤②缺少的操作是 .
(5)如图,是某次滴定时的滴定管中的液面,其读数为mL.![]()
请计算待测烧碱溶液的浓度:mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将NaC1O3和NaI按物质的量之比1:1混合于烧瓶中,滴入适量硫酸,并水浴加热,反应后测得NaC1O3和NaI恰好完全反应,生成I2、Na2SO4和H2O,并产生棕黄色的气体X,则X为
A. Cl2 B. Cl2O C. Cl2O3 D. ClO2
【答案】D
【解析】试题分析:根据转移电子数守恒得,1molNaI中的碘元素由-1价生成单质碘,化合价升高转移1mol电子,故NaClO3中的氯元素化合价降低转移1mol电子,故X气体中氯元素的价态为+4价,答案选D.
考点:氧化还原反应
【题型】单选题
【结束】
25
【题目】把4.48LCO2通过一定量的固体过氧化钠后收集到3.36L气体(气体的测量均在标准状况下),所得气体的总质量是
A. 3.2g B. 4.8g C. 5.4g D. 6g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】农科院研究员在指导农民生产的过程中发现一位农民种植的某块农田小麦产量总是比邻近地块的低。他怀疑该农田可能是缺少某种元素,为此将该块肥力均匀的农田分成面积相等的五小块,进行田间试验。除施肥不同外,其他田间处理措施相同,试验结果如下表:从表中可判断,该农田最可能缺少的元素是
地块 | 甲 | 乙 | 丙 | 丁 | 戊 |
施肥情况 | 尿素 | 磷酸二氢钾 | 磷酸二氢铵 | 硫酸铵 | 不施肥 |
小麦收获量 | 55.56 | 65.26 | 56.88 | 55.44 | 55.11 |
A.NB.K
C.PD.S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在500℃、2×107 Pa和催化剂条件下合成氨工业的核心反应是:N2(g)+3H2(g)2NH3(g)△H=QkJmol﹣1 . 反应过程中能量变化如图所示,回答下列问题: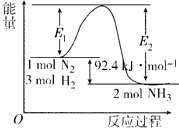
(1)在500℃、2×107Pa和催化剂条件下向一密闭容器中充入0.5mol N2和1.5mol H2 , 充分反应后,放出的热量(填“<”“>”或“=”)46.2kJ,理由是 .
(2)将一定量的H2(g)和N2(g)放入1L密闭容器中,在500℃、2×107 Pa下达到平衡,测得N2为0.10mol,H2为0.30mol,NH3为0.10mol.则该条件下达到平衡时H2的转化率为 . 该温度下的平衡常数K的值为 . 若升高温度,K值(填“增大”“减小”或“不变”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式正确的是( )
A.盐酸:HCl→H++Cl﹣
B.硫酸:H2SO4→H2++SO42﹣
C.硫酸铝:Al2(SO4)3→Al23++(SO4)32﹣
D.氢氧化钠:NaOH→Na++H++O2﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com