
下列实验“操作和现象”与“结论”对应关系正确的是( )
| 操作和现象 | 结论 | |
| A | 处理锅炉水垢中的CaSO4时,依次加入饱和Na2CO3溶液和盐酸,水垢溶解 | 溶解度:S(CaCO3)<S(CaSO4) |
| B | 用石墨作电极电解MgSO4溶液,某电极附近有白色沉淀生成 | 该电极为阳极 |
| C | 向FeCl3和CuCl2混合溶液中加入铁粉,有红色固体析出 | 氧化性:Cu2+>Fe3+ |
| D | 向某溶液中先滴加硝酸酸化,再滴加BaCl2溶液,有白色沉淀生成 | 该溶液中一定含有Ag+ |
|
| A. | A | B. | B | C. | C | D. | D |
| 性质实验方案的设计. . | |
| 专题: | 化学实验基本操作. |
| 分析: | A、依据沉淀转化的依据分析判断; B、阴极上氢离子放电,破坏了水的电离平衡,有关离子浓度增大; C、反应现象只能说明铁置换铜的反应,不能证明阳离子铜离子氧化性和铁离子氧化性的比较; D、溶液中含有亚硫酸根离子液可以出现白色沉淀现象; |
| 解答: | 解:A、硫酸钙和碳酸钙阴离子和阳离子比相同,可以直接比较溶解度和溶度积常数,处理锅炉水垢中的CaSO4时,依次加入饱和Na2CO3溶液和盐酸,水垢溶解,发生了沉淀转化,故A正确; B、用石墨作电极电解MgSO4溶液,某电极附近有白色沉淀生成,依据电解原理分析,阴极是氢离子得到电子生成氢气,电极附近氢氧根离子浓度增大,和镁离子生成沉淀,故B错误; C、向FeCl3和CuCl2混合溶液中加入铁粉,有红色固体析出说明有生成,Cu2+>Fe2+;不能证明铜离子和三价铁离子氧化性的强弱,故C错误; D、向某溶液中先滴加硝酸酸化,硝酸具有强氧化性,溶液中若是亚硫酸根离子,被硝酸氧化为硫酸根离子,再滴加BaCl2溶液,有白色沉淀生成,溶液中不一定含有银离子,故D错误; 故选A. |
| 点评: | 本题考查了物质性质的实验设计和实验检验方法的应用,熟练掌握基础是解题关键,注意干扰离子的分析判断,题目难度中等. |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
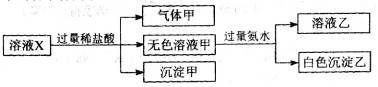
水溶液X中只可能溶有K+、Mg2+、Al3+、[Al(OH)4]-、SiO32-、CO32-、SO32-、SO42-中的若干种离子。某同学对该溶液进行了如下实验:下列判断正确的是
A.气体甲一定是纯净物
B.沉淀甲是硅酸和硅酸镁的混合物
C.K+、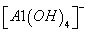 和
和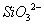 一定存在于溶液X中
一定存在于溶液X中
D.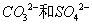 一定不存在于溶液X中
一定不存在于溶液X中
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.化学键存在所有物质中
B.化学键的断裂和形成是化学反应能量变化的主要原因
C.只要有能量变化,则一定发生了化学反应
D.当反应物的总能量低于生成物的总能量时,该反应放出能量
查看答案和解析>>
科目:高中化学 来源: 题型:
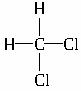
 下列各组物质中属于同系物的是________,互为同分异构体的是________,互为同素异形体的
下列各组物质中属于同系物的是________,互为同分异构体的是________,互为同素异形体的
是________,互为同位素的是________,
属于同一物质的是_ _______。
①C(CH3)4和C4H10 ② 和
③35Cl和37Cl ④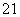 H2O和
H2O和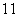 H2O
H2O
⑤石墨和金刚石 ⑦(CH3)2CHCH(CH3)2
和 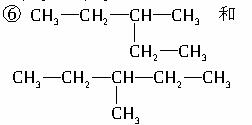 (CH3)2CH(CH2)2CH3
(CH3)2CH(CH2)2CH3
⑧H2 D2 T2 ⑨麦芽糖和蔗糖
⑩硬脂酸甘油酯和油酸甘油酯
⑪CH2=CH-CH2CH3 和 CH3-CH=CH-CH3 ⑫纤维素与淀粉
查看答案和解析>>
科目:高中化学 来源: 题型:
镍镉(Ni﹣Cd)可充电电池在现代生活中有广泛应用.已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiOOH+2H2O Cd(OH)2+2Ni(OH)2,下列说法不正确的是( )
Cd(OH)2+2Ni(OH)2,下列说法不正确的是( )
|
| A. | 放电时化学能不能全部转化为电能 |
|
| B. | 放电时Cd为该电池的负极,充电时这一端应接直流电源的正极 |
|
| C. | 放电时该电池的正极反应为:NiOOH+H2O+e﹣═Ni(OH)2+OH﹣ |
|
| D. | 充电时,阴极反应为:Cd(OH)2+2e﹣═Cd+2OH﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
目前市场上的手提应急灯,主要用的是“无液干粉”铅酸蓄电池,其原理是将强腐蚀性的浓硫酸灌注到硅胶中,使电解质溶液不易发生泄漏,大大改善了电池的性能.所用的原料仍然是Pb﹣PbO2﹣H2SO4,下列关于该铅酸蓄电池的说法正确的是( )
|
| A. | 充电时,电源的正极接蓄电池标“+”的一极,电池上标有“﹣”的一极发生氧化反应 |
|
| B. | “无液干粉”铅酸蓄电池彻底改变了原来的铅酸蓄电池的原理 |
|
| C. | 放电时,在铅酸蓄电池的负极发生还原反应 |
|
| D. | 若用此铅酸蓄电池电解饱和NaCl溶液,标准状况下制备1.12LCl2,电池内至少消耗H2SO40.10 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
设阿伏伽德罗常数为NA,下列说法正确的是
A.pH = 1 的H2SO4溶液中所含H+的个数为0.1NA
B.100mL 0.1mol·L-1的NH4Cl溶液所含NH4+的个数为0.01 NA
C.电解精炼铜的过程中,外电路转移NA个电子,阴极生成铜的质量为32g
D.将2molSO2和10molO2充入一密闭容器中完全反应后,生成SO3的分子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
以下说法正确的是( )
|
| A. | 强电解质的水溶液导电性不一定比弱电解质的水溶液导电性强 |
|
| B. | 较多的金属钠着火可用泡沫灭火器灭火 |
|
| C. | 少量的金属钠可保存在CCl4中 |
|
| D. | 由于Na2O与水反应生成NaOH而导电,所以NaOH是电解质,Na2O是非电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
现有100克碳酸锂和碳酸钡的混和物,它们和一定浓度的盐酸反应时所消耗盐酸跟100克碳酸钙和该浓度盐酸反应时消耗盐酸量相同。计算混和物中碳酸锂和碳酸钡的物质的量之比。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com