
【题目】下面是同学们熟悉的物质:
①O2 ②H2O2 ③MgCl2 ④H2SO4 ⑤Na2CO3⑥NH4Cl ⑦CO2 ⑧Ne ⑨Na2O2 ⑩NaOH
(1)这些物质中,属于共价化合物的是__(填序号,下同);只含有离子键的是__;不含化学键的是__。
(2)写出下列物质的结构式:
①O2__;②H2O2__;⑦CO2__。
(3)写出下列物质的电子式
⑥NH4Cl__;⑩NaOH__。
【答案】②④⑦ ③ ⑧ O=O H-O-O-H O=C=O 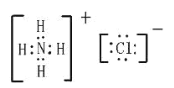
![]()
【解析】
(1)共价化合物是指只含共价键的化合物,H2O2和H2SO4以及CO2中只含共价键,并且属于化合物,所以属于共价化合物的有②④⑦;Na2CO3,NH4Cl,Na2O2以及NaOH中既含有离子键又含有共价键,只有③MgCl2只含有离子键;稀有气体分子都是单原子分子,不含共价键,因此⑧不含共价键;
(2)结构式中用短线表示共用电子对,O2中的O原子之间有两个共用电子对,结构式为O=O;H2O2中,两个H原子分别与一个O原子之间有一个共用电子对,O原子之间还有一个共用电子对,结构式为H-O-O-H;CO2中,C与每个O原子之间都有两个共用电子对,结构式为O=C=O;
(3)NH4Cl是离子化合物,其中包含离子键以及![]() 中的共价键,电子式为
中的共价键,电子式为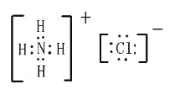 ;NaOH也是离子化合物,其中包含离子键以及OH-中的共价键,电子式为
;NaOH也是离子化合物,其中包含离子键以及OH-中的共价键,电子式为![]() 。
。


科目:高中化学 来源: 题型:
【题目】新型锌碘液流电池具有能量密度高、循环寿命长等优势,其工作原理如图所示。下列说法错误的是

A. 放电时电流从石墨电极流向锌电极
B. 充电时阳极反应式为:3I--2e-=I3-
C. 若将阳离子交换膜换成阴离子交换膜,放电时正负极也随之改变
D. 放电时左侧电解质储罐中的离子总浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究电化学腐蚀及防护的装置如右图所示。下列有关说法错误的是( )

A. d为石墨,铁片腐蚀加快
B. d为石墨,石墨上电极反应为:O2 + 2H2O + 4e == 4OH–
C. d为锌块,铁片不易被腐蚀
D. d为锌块,铁片上电极反应为:2H+ + 2e == H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于敞口容器中的化学反应:Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g),下列叙述中不正确的是( )

A. Zn和H2SO4的总能量大于ZnSO4和H2的总能量
B. 反应过程中能量关系可用上图表示
C. 若将该反应设计成原电池,则Zn为负极
D. 若将该反应设计成原电池,当有32.5g锌溶解时正极放出22.4 L气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列四种溶液:①c(H+)=10-3mol·L-1的醋酸 ②0.01mol·L-1的盐酸 ③0.1mol·L-1的NaOH溶液 ④c(OH-)=1mol·L-1氨水溶液。由水电离出的氢离子浓度之比为
A. 1000∶100∶10∶1 B. 11∶12∶1∶0
C. 11∶12∶13∶14 D. 3∶2∶13∶14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO2、NO、SO2、CO等大气污染气体的处理具有重要意义。利用反应6NO2(g)+8NH3(g)![]() 7N2(g)+12H2O(g)可处理NO2。
7N2(g)+12H2O(g)可处理NO2。
(1)在2L的密闭容器中,2分钟内,上述反应混合物的物质的量增加了0.25mol,则2分钟内v(NH3)=______。
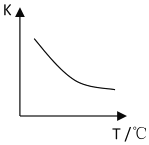
(2)该反应的化学平衡常数表达式K=______;已知该反应平衡常数(K)与温度(T)的关系如图所示,若升高温度,则v正反应______v逆反应(填“大于”、“小于”或“等于”);反应达到平衡后若缩小反应容器体积,其它条件不变,则混合气体的平均式量将______(填“变大”、“变小”或“不变”)。
酸雨是大气污染的危害之一,二氧化硫(SO2)的含量是空气质量监测的一个重要指标。某兴趣小组同学收集某地的雨水进行实验,每隔1h,通过pH计测定雨水样品的pH,测得的结果如下表:
测定时间/h | 0 | 1 | 2 | 3 | 4 |
雨水样品的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
(3)请写出上述pH变化的原因______。
(4)有物质的量浓度相等的三种铵盐溶液:①NH4Cl ②NH4HCO3 ③NH4HSO4,这三种溶液中水的电离程度由大到小的顺序是______(填编号)。
(5)向BaCl2溶液中通入足量SO2气体,没有沉淀生成,继续滴加一定量的氨水后,生成BaSO3沉淀,用电离平衡原理解释上述现象。______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学方程式中,属于水解反应的是( )
A. H2O+H2O ![]() H3O++OH-
H3O++OH-
B. HS-+OH- ![]() H2O+S2-
H2O+S2-
C. HS-+H2O ![]() H3O++S2-
H3O++S2-
D. HS-+H2O ![]() H2S+OH-
H2S+OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,2SO2(g)+O2(g)![]() 2SO3(g),反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的△H=-99 kJ·mol-1。
2SO3(g),反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的△H=-99 kJ·mol-1。

(1)图中△H=___________kJ·mol-1(填数值);
(2)写出SO3(g)分解成SO2(g)和O2(g)的热化学方程式:_____________________。
(3)加入催化剂(V2O5)会使图中B点___________(填“升高”或“降低”)。
(4)从化学键角度分析,E表示的意义:______________________________。
(5)某工业生产实验数据如下:
温度 | 压强不同时SO2的转化率(%) | ||||
1.01×105 Pa | 5.05×105 Pa | 1.01×106 Pa | 5.05×106 Pa | 1.01×107 Pa | |
450℃ | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
550℃ | 85.6 | 92.9 | 94.9 | 97.7 | 98.3 |
你认为最适宜的条件是______________________。
(6)已知由S(s)生成3 mol SO3(g)共放出1185 kJ的热量,单质硫的燃烧热为_____kJ·mol-1。
(7)尾气SO2可以用氨水吸收除去。
已知25℃时,NH3·H2O 的Kb=1.8×10-5,H2SO3:Ka1=1.3×10-2、Ka2=6.2×10-8。
①若氨水的浓度为2.0 mol/L,溶液中的c(OH-)=___________mol/L。
②将SO2 通入该氨水中,当c(OH-)降至1.0×10-7 mol/L时,溶液中的c(SO32-)/c(HSO3-)=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气(气体体积已折算为标准状况下的体积),实验记录如下(累计值):
时间/min | 1 | 2 | 3 | 4 | 5 |
氢气体积/mL | 50 | 120 | 232 | 290 | 310 |
(1)反应速率最大的时间段是__(填“0~1min”“1~2min”“2~3min”或“4~5min”),原因是__。
(2)反应速率最小的时间段是__(填“0~1min”“1~2min”“2~3min”或“4~5min”),原因是__。
(3)2~3min时间段内,以盐酸的浓度变化表示该反应的速率为__。
(4)如果反应太剧烈,为了减缓反应速率而又不减少产生氢气的量,该同学在盐酸中分别加入等体积的下列液体,你认为可行的是__(填序号)。
A.蒸馏水 B.NaCl溶液 C.Na2CO3溶液 D.CuSO4溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com