
【题目】下列化学方程式中,属于水解反应的是( )
A. H2O+H2O ![]() H3O++OH-
H3O++OH-
B. HS-+OH- ![]() H2O+S2-
H2O+S2-
C. HS-+H2O ![]() H3O++S2-
H3O++S2-
D. HS-+H2O ![]() H2S+OH-
H2S+OH-
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】在标准状况下进行甲、乙、丙三组实验:各取30mL同浓度的盐酸溶液,加入不同质量的同一种镁铝合金粉末,产生气体,有关数据记录如下:
实验序号 | 甲 | 乙 | 丙 |
合金质量(g) | 0.255 | 0.385 | 0.459 |
生成气体体积(mL) | 280 | 336 | 336 |
试回答:
(1)计算出盐酸的物质的量浓度为_______________mol/L(保留两位有效数字);
(2)镁、铝的物质的量之比为__________________;
(3)第三组还需要_____________mL的盐酸才能反应完全。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有甲、乙、丙、丁四个装置,下列说法不正确的是
A. 装置甲可作为制取NO2的发生装置
装置甲可作为制取NO2的发生装置
B. 装置乙可作为制取NO的收集装置
装置乙可作为制取NO的收集装置
C. 装置丙可作为制取Cl2的尾气吸收装置
装置丙可作为制取Cl2的尾气吸收装置
D. 装置丁可用于除去NH3中H2O
装置丁可用于除去NH3中H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是同学们熟悉的物质:
①O2 ②H2O2 ③MgCl2 ④H2SO4 ⑤Na2CO3⑥NH4Cl ⑦CO2 ⑧Ne ⑨Na2O2 ⑩NaOH
(1)这些物质中,属于共价化合物的是__(填序号,下同);只含有离子键的是__;不含化学键的是__。
(2)写出下列物质的结构式:
①O2__;②H2O2__;⑦CO2__。
(3)写出下列物质的电子式
⑥NH4Cl__;⑩NaOH__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸晶体的组成可表示为H2C2O4·xH2O,为了测定x值,进行下述实验:
①称取n g草酸晶体配成100.00 mL水溶液;
②取25.00 mL所配制的草酸溶液置于锥形瓶中,加稀硫酸,用浓度为a mol·L-1的KMnO4溶液滴定,已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O
试回答下列问题:
(1)实验中不考虑铁架台等夹持仪器外,需要的仪器有(填序号)___________,还缺少的仪器有(填名称)____________。
A.托盘天平(带砝码,镊子) B.滴定管 C. 100mL容量瓶 D.烧杯E.漏斗 F.锥形瓶 G.玻璃棒 H.烧瓶
(2)实验中KMnO4溶液应装在____式滴定管中,滴定终点的判断依据是_________________
(3)若在滴定前没有用amol·L-1的KMnO4溶液对滴定管进行润洗,则所测得的x值会___________(偏大、偏小、无影响)。
(4)若滴定终点读数时目光仰视,则计算出的x值可能_______________(填偏大、偏小、无影响)。
(5)滴定过程中用去V mL a mol·L-1的KMnO4溶液,则所配制的草酸的物质的量浓度为_______mol·L-1 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、P、Q为五种短周期元素,其原子半径和最外层电子数之间的关系如下图所示。下列说法正确的是

A. Q的氧化物一定含有离子键和共价键 B. 最高价含氧酸的酸性:Z<Y
C. P的最低价氢化物常温常压下为液体 D. Y形成的化合物种类最多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.化合物 Mg5Al3(OH)19(H2O)4 可作环保型阻燃材料,受热时按如下化学方程式分解:2Mg5Al3(OH)19(H2O)4![]() 27H2O↑+10MgO+3Al2O3
27H2O↑+10MgO+3Al2O3
(1)写出该化合物作阻燃剂的两条依据___________。
(2)用离子方程式表示除去固体产物中 Al2O3 的原理___________
(3)已知 MgO可溶于NH4Cl的水溶液,用化学方程式表示其原理_____________。
Ⅱ.磁性材料 A(M=296g/mol)是由两种元素组成的化合物,某研究小组按如图流程探 究其组成:

请回答:
(4)A的化学式为_____。C 中呈黄色的离子对应元素在元素周期表中的位置为__________。
(5)已知化合物 A 能与稀硫酸反应,生成一种淡黄色不溶物和一种气体(标况下,该气体对氨气的相对密度为2),该气体分子的电子式为_____。写出该反应的离子方程式_________。
(6)写出F→G反应的化学方程式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“封管实验”具有简易、方便、节约、绿色等优点,下列关于三个“封管实验”(夹持装置未画出)的说法正确的是( )

A. 加热时,①中上部汇集了NH4Cl固体
B. 加热时,②中溶液变红,冷却后又都变为无色
C. 加热时,③中溶液红色褪去,冷却后溶液变红,体现SO2的漂白性
D. 三个“封管实验”中所发生的化学反应都是可逆反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以苯甲醛为原料制备间溴苯甲醛的反应如下:
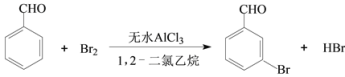
已知:(1)间溴苯甲醛温度过高时易被氧化。
(2)溴、苯甲醛、1,2-二氯乙烷、间溴苯甲醛的沸点见下表:
物质 | 溴 | 苯甲醛 | 1,2-二氯乙烷 | 间溴苯甲醛 |
沸点/℃ | 58.8 | 179 | 83.5 | 229 |
步骤1:将一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛充分混合后装入三颈烧瓶(如右图所示),缓慢滴加经浓硫酸干燥过的足量液溴,控温反应一段时间,冷却。

步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液。有机层用10% NaHCO3溶液洗涤。
步骤3:经洗涤的有机层加入适量无水MgSO4固体,放置一段时间后过滤出
MgSO4nH2O晶体。
步骤4:减压蒸馏有机层,收集相应馏分。
(1)实验装置中冷凝管的主要作用是_____,锥形瓶中应为_____(填化学式)溶液。
(2)步骤1反应过程中,为提高原料利用率,适宜的温度范围为(填序号)_______。
A.>229℃ B.58.8℃~179℃ C.<58.8℃
(3)步骤2中用10% NaHCO3溶液洗涤,是为了除去溶于有机层的___(填化学式)。
(4)步骤3中加入无水MgSO4固体的作用是_____。
(5)步骤4中采用减压蒸馏,是为了防止______。
(6)若实验中加入了5.3 g苯甲醛,得到3.7 g间溴苯甲醛。则间溴苯甲醛产率为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com