
【题目】工业上制备有机氟化剂![]() 的反应
的反应![]() 。下列说法正确的是
。下列说法正确的是
A.NaF既不做氧化剂也不做还原剂,![]() 为氧化产物
为氧化产物
B.![]() 与
与![]() 两种物质中的氯元素化合价不同
两种物质中的氯元素化合价不同
C.还原剂与氧化剂物质的量之比为2:1
D.![]() 属于有机物
属于有机物
【答案】A
【解析】
A.NaF中钠元素和氟元素化合价均未变化,既不做氧化剂也不做还原剂,SCl2中硫元素化合价为+2价,SF4中硫元素化合价为+4,SF4为氧化产物,A正确;
B.SCl2中氯元素化合价为-1价,S2Cl2中氯元素化合价为-1价,Cl的化合价相同,B错误;
C.SCl2中硫元素化合价为+2价,氯元素化合价为-1价,S2Cl2中硫元素化合价为+1,氯元素化合价为-1价,S2Cl2为还原产物,SF4中硫元素化合价为+4,SF4为氧化产物,SCl2既做氧化剂又做还原剂,氧化剂与还原剂物质的量之比为2:1,C错误;
D.有机物含有C元素,SF4中没有C元素,不是有机物,D错误;
故选A。


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】高锰酸钾是一种重要的氧化剂,某化学实验小组制备高锰酸钾并测其纯度的步骤如下,请回答相关问题:
![]()
Ⅰ.高锰酸钾的制备
(1)将![]() 和
和![]() 固体混匀放入坩埚中,边加热边搅拌,待熔融后慢慢加入
固体混匀放入坩埚中,边加热边搅拌,待熔融后慢慢加入![]() 粉末,不断搅拌,呈颗粒状后,再加强热
粉末,不断搅拌,呈颗粒状后,再加强热![]() 得墨绿色产物(
得墨绿色产物(![]() 为墨绿色固体),冷却。
为墨绿色固体),冷却。
①制![]() 反应的化学方程式为____。
反应的化学方程式为____。
②实验中使用的坩埚及搅拌棒的材质可以是________。
A.石英 B.瓷 C.刚玉(氧化铝) D.铁
(2)取出墨绿色产物研细,每次用![]() 4%的热
4%的热![]() 溶液浸取,过滤后对滤渣重复浸取两次。合并三次浸取液,得墨绿色溶液。将墨绿色产物研细并分三次浸取,这样做的目的是_________。
溶液浸取,过滤后对滤渣重复浸取两次。合并三次浸取液,得墨绿色溶液。将墨绿色产物研细并分三次浸取,这样做的目的是_________。
(3)![]() 在水溶液中会发生歧化反应:
在水溶液中会发生歧化反应:![]() ,通入
,通入![]() 气体可促进反应趋于完全。向(2)制得的墨绿色溶液中连续通入
气体可促进反应趋于完全。向(2)制得的墨绿色溶液中连续通入![]() 气体至溶液
气体至溶液![]() 在10~11之间,过滤。滤液中的溶质除
在10~11之间,过滤。滤液中的溶质除![]() 外,还主要含有_____。
外,还主要含有_____。
(4)将滤液转入蒸发皿,小火加热,当看到________的现象时停止加热,冷却,________、________,干燥后得![]() 粗品。
粗品。

Ⅱ.高锰酸钾纯度的测定
(5)称取![]() 粗品,加入煮沸并冷却后的稀硫酸配成
粗品,加入煮沸并冷却后的稀硫酸配成![]() 溶液。量取
溶液。量取![]() 的草酸(
的草酸(![]() )溶液于锥形瓶中,用所配
)溶液于锥形瓶中,用所配![]() 溶液进行滴定。重复滴定两次,平均消耗
溶液进行滴定。重复滴定两次,平均消耗![]() 溶液的体积为
溶液的体积为![]() 。
。
①滴定开始时,溶液颜色褪去较慢,随后加快,原因是________。
②滴定终点的标志是___________。
③![]() 纯度(质量分数)的计算式为________。
纯度(质量分数)的计算式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在硫酸铜溶液中加入过量KCN,发生反应:CuSO4+4KCN=K2[Cu(CN)4]+K2SO4。
回答下列问题:
(1)基态铜原子的电子排布式为_____________。
(2)N、O、S元素分别与H形成的二元共价化合物中,既含有极性共价键,又含有非极性共价键的化合物是_____________(填化学式,写出两种)。
(3)N2O5晶体由两种离子构成,已知其阴离子(NO3-)的立体构型为平面三角形,则其阳离子(NO2+)的立体构型为_____________,阳离子中氮的杂化方式为_____________。
(4)相同条件下,SO2、CO2在水中的溶解度较大的是_______________(填分子式),理由是_________________________________________________________________。
(5)N、O元素第一电离能的大小关系为__________(用元素符号表示),原因为____________。
(6)铜晶体为面心立方最密堆积,配位数为_____________,铜的原子半径为127.8 pm,NA表示阿伏加德罗常数的值,列出铜晶体的密度计算式:_____________g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2CH3OH(g)![]() CH3OCH3(g)+H2O(g) ΔH=-25 kJ·mol-1。某温度下的平衡常数为400。此温度下,在1 L体积不变的密闭容器中加入CH3OH,某时刻测得各组分的物质的量浓度如下表。下列说法中不正确的是( )
CH3OCH3(g)+H2O(g) ΔH=-25 kJ·mol-1。某温度下的平衡常数为400。此温度下,在1 L体积不变的密闭容器中加入CH3OH,某时刻测得各组分的物质的量浓度如下表。下列说法中不正确的是( )
物质 | CH3OH | CH3OCH3 | H2O |
c/mol·L-1 | 0.08 | 1.6 | 1.6 |
A. 此时刻反应达到平衡状态
B. 容器内压强不变时,说明反应达平衡状态
C. 平衡时,再加入与起始等量的CH3OH,达新平衡后CH3OH转化率不变
D. 平衡时,反应混合物的总能量降低40 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知CrO42-和Cr2O72-在溶液中可相互转化。室温下,初始浓度为1.0 mol·L-1的Na2CrO4溶液中c(Cr2O72-)随c(H+)的变化如图所示。

(1)用离子方程式表示Na2CrO4溶液中的转化反应______。
(2)由图可知,溶液酸性增大,CrO42-的平衡转化率____(填“增大”“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为________。
(3)升高温度,溶液中CrO42-的平衡转化率减小,则该反应的ΔH________0(填“大于”“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是以秸秆为原料制备某种聚酯高分子化合物的合成路线:
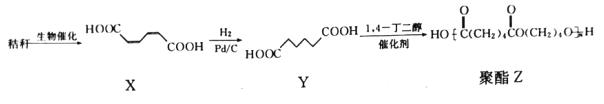
下列有关说法正确的是
A.X的化学式为C4H6O4
B.Y分子中有1个手性碳原子
C.生成聚酯Z的反应类型为加聚反应
D.制备聚酯Z,消耗Y和1,4-丁二醇的物质的量之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据预测,到2040年我国煤炭消费仍将占能源结构的三分之一左右。H2S在催化活性碳(AC)表面的迁移,对煤的清洁和综合应用起了很大的促进作用,其机理如图所示,其中ad表示物种的吸附状态。下列有关叙述错误的是

A.图中阴影部分表示H2S分子的吸附与离解
B.AC表面作用的温度不同,H2S的去除率不同
C.H2S在AC表面作用生成的产物有H2O、H2、S、SO2、CS2等
D.图中反应过程中只有H—S键的断裂,没有H—S键的形成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列三个化学反应的平衡常数(K1、K2、K3)与温度的关系分别如表所示:
化学反应 | 平衡常数 | 温度 | |
973K | 1173K | ||
①Fe(s)+CO2(g) | K1 | 1.47 | 2.15 |
②Fe(s)+H2O(g) | K2 | 2.38 | 1.67 |
③CO(g)+H2O(g) | K3 | ? | ? |
下列说法正确的是
A.ΔH1<0,ΔH2>0
B.反应①②③的反应热满足关系:ΔH1-ΔH2=ΔH3
C.反应①②③的平衡常数满足关系:K1·K2=K3
D.要使反应③在一定条件下建立的平衡向正反应方向移动,可采取降温措施
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烯烃复分解反应可形象地描述为交换舞伴(如图所示):

烯烃复分解反应中的催化剂是金属卡宾(如CH2=M),金属卡宾与烯烃分子相遇后,两对舞伴会暂时组合起来,手拉手跳起四人舞蹈。随后它们“交换舞伴”,组合成两个新分子,其中一个是新的烯烃分子,另一个是金属原子和它的新舞伴。后者会继续寻找下一个烯烃分子,再次“交换舞伴”。根据以上信息进行判断,如果把C6H5CH2CH=CH2与CH2=M在一定条件下混合反应,下列产物不可能存在的是 ( )
A. C6H5CH2CH=M B. CH2=CH2
C. C6H5CH2CH2C6H5 D. C6H5CH2CH=CHCH2C6H5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com